II тип. Реакции окисления
При обычных условиях парафины не окисляются ни кислородом, ни сильными окислителями (KMnO4, HNO3, K2Cr2O7 и др.).
При внесении открытого пламени в смесь углеводорода с воздухом происходит полное окисление (сгорание) углеводорода до СО2 и Н2О. Нагревание предельных углеводородов в смеси с воздухом или кислородом в присутствии катализаторов окисления MnО2 и других до температуры 300оС приводит к их окислению с образованием перекисных соединений. Реакция протекает по цепному свободно-радикальному механизму.
И: R : H 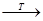 R. + H. инициирование цепи
R. + H. инициирование цепи
.. ..
Р: R. + O: :O:  R-O-O.
R-O-O.
.. ..
R-O-O. + R : H  R-O-O-H + R.
R-O-O-H + R.
гидроперекись алкана
O: R-O-O. + R.  R-O-O-R обрыв цепи
R-O-O-R обрыв цепи
перекись алкана
Легче всего подвергаются окислению третичные звенья, труднее вторичные и еще труднее – первичные. Образующиеся гидроперекиси разлагаются.
Первичные гидроперекиси при разложении образуют альдегиды или первичный спирт, например:
Н Н
СН3-С-С-О : О-Н  CН3-С-О . + . ОН
CН3-С-О . + . ОН  СН3-С=О + Н2О
СН3-С=О + Н2О
Н Н Н
гидроперекись этана уксусный альдегид
+ СН3-СН3
побочная
СН3-СН2ОН + СН3-СН2 .
Вторичные гидроперекиси образуют при разложении кетоны или вторичные спирты, например:
Н Н
СН3-С-О:ОН  СН3-С-О . + . ОН
СН3-С-О . + . ОН 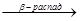 Н2О + СН3-С=О
Н2О + СН3-С=О
СН3 СН3 СН3
гидроперекись пропана
+ СН3-СН2-СН3
побочная
СН3-СН-ОН + СН3-. СН-СН3
СН3
изопропиловый спирт
Третичные гидроперекиси образуют кетоны, а также первичные и третичные спирты, например:
СН3 СН3 СН3
СН3-С-СН3  СН3-С : СН3 + . ОН
СН3-С : СН3 + . ОН 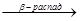 СН3ОН + СН3-С=О
СН3ОН + СН3-С=О
О-ОН О
гидроперекись изобутана
+ СН3-СН-СН3
СН3
Побочная
Изобутан
СН3 .
СН3-С-СН3 + СН3-С-СН3
ОН СН3
третбутиловый спирт
Любая гидроперекись может разлагаться также с выделением атомарного кислорода: СН3-СН2-О-О-Н  СН3СН2-ОН + [O],
СН3СН2-ОН + [O],
который идет на дальнейшее окисление:
О О
СН3-С + [О]  СН3-С-ОН
СН3-С-ОН
Н
Поэтому кроме спиртов, альдегидов и кетонов образуются карбоновые кислоты.
Подбором условий реакции можно добиться получения одного какого-либо продукта. Например: 2 СН4 + О2 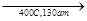 2 СН3ОН.
2 СН3ОН.
В промышленных масштабах окислением предельных углеводородов (С10-С20) получают синтетические жирные кислоты (СЖК).
По мере увеличения углеводородной цепочки способность углеводорода к окислению увеличивается. Например, эйкозан окисляется при 100оС.
Н
С17Н35-СН2-СН2-СН3 + О2  С17Н35-СН2-С-СН3
С17Н35-СН2-С-СН3 
эйкозан О-ОН
гидроперекись эйкозана
О О
 Н2О + С17Н35-СН2 + С-СН3
Н2О + С17Н35-СН2 + С-СН3  С17Н35-С-ОН + СН3-С-ОН
С17Н35-С-ОН + СН3-С-ОН
О
метилоктадецилкетон стеариновая кислота
2-нонадеканон (октадекановая)
Используется для производства мыла, ее натриевой соли, стеарата натрия.
III тип. Реакции термического расщепления
предельных углеводородов
1.Крекинг – расщепление предельных углеводородов на более низкомолекулярные предельные и непредельные углеводороды. Протекает при нагревании без доступа воздуха до 450-550оС. Механизм термического крекинга – свободно-радикальный.

 2 1 1 СН3-СН2-СН2 . . СН3
2 1 1 СН3-СН2-СН2 . . СН3  СН3-СН=СН2+СН4
СН3-СН=СН2+СН4
 СН3-СН2 : СН2 : СН3
СН3-СН2 : СН2 : СН3
 бутан 2 СН3-СН2 . + . СН2-СН3
бутан 2 СН3-СН2 . + . СН2-СН3  СН2=СН2+СН3-СН3
СН2=СН2+СН3-СН3
При расщеплении более высокомолекулярных углеводородов при невысоком давлении могут протекать реакции 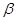 -распада образовавшихся свободных радикалов.
-распада образовавшихся свободных радикалов.
С10Н22  2СН3-СН2-СН2 : СН2-СН2
2СН3-СН2-СН2 : СН2-СН2  2СН3-СН2-СН2 . + 2СН2=СН2
2СН3-СН2-СН2 . + 2СН2=СН2
Декан 2С10Н22
2С10Н21 . + 2СН3-СН2-СН3
2.Дегидрирование (дегидрогенизация) – отщепление водорода происходит под действием более высокой температуры, чем крекинг.
 СН3-СН=СН-СН3 2-бутен
СН3-СН=СН-СН3 2-бутен
СН3-СН2-СН2-СН3 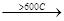
бутан -Н2
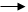 СН3-СН2-СН=СН2 1-бутен
СН3-СН2-СН=СН2 1-бутен
В присутствии катализаторов, например, Сr2O3, температура реакции может быть снижена до 300оС.
Дата добавления: 2014-12-24; просмотров: 1992;
