Температуры кипения и замерзания идеального бинарного раствора
с нелетучим растворённым веществом. Эбуллиоскопия. Криоскопия.
На основе закона Рауля можно установить:
1. изменение температуры кипения раствора по сравнению с температурой чистого растворителя при одинаковом внешнем давлении;
2. изменение температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя при одинаковом внешнем давлении.
Жидкость закипает при той температуре, при которой давление насыщенного пара над ней становится равным внешнему (Р = Рвн).
Так как для раствора с нелетучим растворённым веществом при любой температуре Р всегда меньше, чем Рi0, температура кипения раствора (Ткип) всегла выше, чем температура кипения чистого растворителя (Т 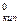 ).
).
Установлено, что ΔТкип = Ткип - Т 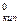 пропорционально моляльной (b) концентрации раствора:
пропорционально моляльной (b) концентрации раствора:
 ΔТкип = Е · b, (77)
ΔТкип = Е · b, (77)
где Е – коэффициент пропорциональности, называемый эбуллиоскопической постоянной.
Эбуллиоскопическая постоянная не зависит ни от природы растворённого вещества, ни от его концентрации, а определяется свойствами чистого растворителя:
Е = 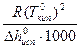 , (78)
, (78)
где R – универсальная газовая постоянная; Т 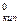 ,
, 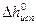 - соответственно температура кипения и удельная теплота испарения чистого растворителя.
- соответственно температура кипения и удельная теплота испарения чистого растворителя.
Для воды Е равна 0,52 град · кг/моль.
Для раствора, содержащего m2 граммов растворённого вещества, молярной массой М2, в m1 граммах Н2О, моляльность раствора рассчитывается по формуле:
b = 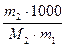 . (79)
. (79)
Тогда температура кипения раствора определяется по формуле:
Ткип = Т 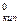 + Е
+ Е 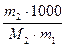 , (80)
, (80)
где Т 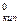 - температура кипения чистой воды, значения её приведены в справочниках.
- температура кипения чистой воды, значения её приведены в справочниках.
Если не известна молярная масса растворённого вещества (М2), то её находят по формуле:
М2 =  , (81)
, (81)
 где ΔТкип = Ткип - Т
где ΔТкип = Ткип - Т 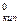 находят экспериментальным путём.
находят экспериментальным путём.
Метод исследования, основанный на экспериментальном определении температуры кипения раствора, называется эбуллиоскопией. Он применяется при изучении реальных разбавленных растворов.
Любая жидкость замерзает при той температуре, при которой давление насыщенного пара над ней становится равным давлению насыщенного пара над кристаллами.
Очевидно, что температура замерзания раствора (Тз) всегда меньше, чем температура замерзания чистого растворителя (Т 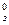 ):
):
ΔТз = Т 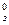 - Тз > 0.
- Тз > 0.
Наблюдаемое понижение температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя связано с концентрацией раствора уравнением:
ΔТз = Кb, (82)
где b – моляльность раствора, К – коэффициент пропорциональности, называемый криоскопической постоянной.
Криоскопическая постоянная не зависит ни от природы растворённого вещества, ни от его концентрации, а определяется свойствами чистого растворителя:
К = 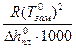
 , (83)
, (83)
где Т 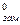 ,
, 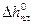 - соответственно температура замерзания и удельная теплота плавления чистого растворителя.
- соответственно температура замерзания и удельная теплота плавления чистого растворителя.
Её физический смысл заключается в том, что она численно равна ΔТз раствора, моляльность которого равна 1 моль на 1 кг растворителя.
Для воды, как наиболее распространённого растворителя,
К 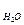 = 1,86
= 1,86 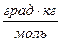 .
.
Определив опытным путём понижение температуры замерзания раствора и используя формулы (82) и (83), можно рассчитать молекулярный вес растворённого вещества – неэлектролита. Данный метод криоскопии широко применяется в лабораторной практике.
Пример 12. Выразить концентрацию водного раствора глицерина С3Н8О3 в весовых процентах, если он замерзает при -0,52ºС.
Решение. Находим понижение температуры замерзания:
ΔТз = Т 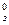 - Тз = 0 – (- 0,52) = 0,52.
- Тз = 0 – (- 0,52) = 0,52.
По формуле (82) вычисляем моляльную концентрацию раствора:
b = 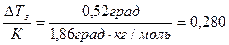 моль в 1000 г воды.
моль в 1000 г воды.
Мм(С3Н8О3) = 92 г/моль, следовательно, в 1000 г воды содержится 0,280 моль ∙ 92 г/моль = 25,76 г глицерина.
Общая масса раствора равна 1000 + 25,76 = 1025,76 г глицерина.
Составляем пропорцию:
В 1025,76 г раствора содержится 25,76 г глицерина.
В 100 г раствора содержится x г глицерина.
х =  2,51 %.
2,51 %.
Пример 13. При какой примерно температуре должен замерзать 40%-ный водный раствор этилового спирта?
Решение. Используя формулы (82) и (79), получаем:
ΔТз = Кb = К 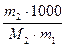 = 1,86
= 1,86 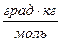 .
. 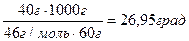 .
.
ΔТз = Т  - Тз, ΔТз = 0 – 26,95 = - 26,95 ºС.
- Тз, ΔТз = 0 – 26,95 = - 26,95 ºС.
Вариант 1.
7. Вычислить осмотическое давление раствора сахарозы при 0ºС, если при 20ºС осмотическое давление этого же раствора равно 1,066·105 Н/м2.
8. Вычислить давление пара 20%-ного раствора глюкозы (С6Н12О6) при 25ºС. Давление паров воды при данной температуре 3167,73 Н/м2.
9. Определить концентрацию (вес.%) водного раствора глюкозы, если он замерзает при -1ºС.
Вариант 2.
7. Осмотическое давление раствора неэлектролита при 17ºС равно 4,82∙105Н\м2. Определить осмотическое давление этого раствора при 57ºС.
8. вычислить давление пара раствора 6,4 г нафталина в 90 г бензола при 20ºС. Давление паров бензола при данной температуре 9953,82 Н/м2.
9. Определить концентрацию сахара в растворе (вес.%), если раствор закипает при 100,5ºС.
Вариант 3.
7. Рассчитать молекулярный вес мочевины, если водный раствор, содержащий 0,368 г мочевины в 200 см3 воды при 20ºС, имеет осмотическое давление 74 630 Н/м2.
8. В 150 г водного раствора содержится 34,2 г тростникового сахара С12Н22О11. Вычислить давление пара этого раствора при 30ºС, если давление паров воды 4242,30 Н/м2.
9. Какое количество глицерина нужно добавить к 1000 г воды, чтобы раствор не замерзал до -5ºС?
Вариант 4.
7. Вычислить осмотическое давление при 25ºС водного раствора, содержащего 225 г сахара (С12Н22О11) в 5 л раствора.
8. Сколько граммов глицерина С3Н8О3 надо растворить в 90 г воды при 30ºС, чтобы понизить давление пара на 266,5 Н/м2? При 30ºС р 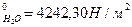 .
.
9. При какой приблизительно температуре будет замерзать 45%-ный раствор метилового спирта (СН3ОН) в воде?
Вариант 5.
7. Вычислить осмотическое давление 2,5%-ного раствора тростникового сахара (С12Н22О11) при 27ºС. Плотность раствора принять равной единице.
8. Какое количество воды следует взять, чтобы, растворив в нём 4,5 г глицерина при 27ºС, понизить давление пара на 399,7 Н/м2? р 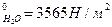 .
.
9. Какой из растворов будет замерзать при более низкой температуре, 5%-ный раствор глицерина или 5%-ный раствор глюкозы? Дайте мотивированный ответ, не производя вычислений.
Вариант 6.
7. Осмотическое давление раствора, содержащего в 500 см3 1,55 г анилина при 21ºС , равно 0,8104·105 Н/м2. Определить молекулярный вес анилина.
8. В 200 г раствора нафталина С10Н8 в бензоле С6Н6 содержится 60 г нафталина. Вычислить давление пара данного раствора при 40ºС. Давление пара бензола для данной температуры 24144,6 Н/м2.
9. При растворении 6,48 г серы в 80 г бензола температура кипения последнего повысилась на 0,81º. Из скольких атомов состоит молекула серы в растворе?
Вариант 7.
7. Определить молекулярный вес растворённого вещества, если раствор, содержащий 12 г растворённого вещества в литре, при 17ºС обладает осмотическим давлением, равным 1,82·105Н/м2.
8. В каком количестве бензола С6Н6 нужно растворить 8Ю90 г антрацена С14Н10, чтобы при 20ºС давление пара понизилось на 379,7 Н/м2? р  = 9954 Н/м2.
= 9954 Н/м2.
9. Имеются 25%-ные водные растворы мочевины, глицерина и фруктозы. в какой последовательности будут закипать эти растворы при постепенном нагревании их ? Дать обоснованный ответ, не прибегая к вычислениям.
Вариант 8.
7. Раствор, содержащий 9 г растворённого вещества (неэлектролита) в 250 см3 раствора, обладает осмотическим давлением 4,56·105Н/м2 при 0ºС. Определить молекулярный вес растворённого вещества.
8. Сколько граммов нафталина нужно растворить в 100 г бензола при 20ºС, чтобы понизить давление пара на 666,4 Н/м2? р  = 9954 Н/м2.
= 9954 Н/м2.
9. Сколько граммов глюкозы нужно добавить к 100 г воды, чтобы расвтор закипел при 102,5ºС?
Вариант 9.
7. Сколько граммов этилового спирта (С2Н5ОН) нужно растворить в 200 см3 воды, чтобы осмотическое давление этого раствора при 17ºС было равным 2,026·105 Н/м2.
8. Вычислить давление пара 5%-ного раствора анилина С6Н5NH2 в эфире (С2Н5)О при 20ºС. Давление пара чистого эфира при этой температуре 58920 Н/м2.
9. Температура замерзания чистого бензола 5,500ºС, а раствора, содержащего 0,2242 г камфоры в 30,55 г бензола 5,254ºС. Определить молекулярный вес камфоры в бензоле.
Вариант 10.
7. Сколько молей неэлектролита должен содержать 1 л раствора, чтобы осмотическое давление при 0ºС равнялось 2,53∙105 Н/м2?
8. Определить количество сахара С12Н22О11, растворённого в 270 г воды, если давление пара раствора при 70ºС 30 470 Н/м2. Давление пара воды при заданной температуре 31 157,4 Н/м2.
9. Давление пара раствора тростникового сахара в 1000 г воды 100 200 Н/м2 при 100ºС. вычислить температуру кипения и осмотическое давление этого раствора при той же температуре. Плотность раствора принять равной 1.
Дата добавления: 2014-12-07; просмотров: 4386;
