Реакции нулевого порядка
В общем виде кинетическое уравнение реакции нулевого порядка выглядит следующим образом:
 или –dc = k·dτ.
или –dc = k·dτ.
Скорость реакции постоянна и не зависит от концентрации реагирующих веществ. После интегрирования получаем:
- c = k·τ + B,
где В – постоянная интегрирования.
При τ = 0 В = - с0. Тогда
с = с0 - k·τ
k = 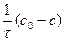 , (88)
, (88)
где с0, с – начальная концентрация исходного вещества и концентрация в момент времени τ от начала реакции.
Константу скорости реакции нулевого порядка измеряют в моль/дм3·время.
Если с = с0/2, то τ = τ1/2. тогда
k = 

или
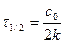 , (89)
, (89)
где τ1/2 - период полупревращения.
Период полупревращения – это время, в течение которого в реакцию вступит половина исходного количества вещества.
Для реакции нулевого порядка период полупревращения возрастает с увеличением начальной концентрации реагентов. Реакциями нулевого порядка, как правило, являются гетерогенные реакции, происходящие на поверхности.
Дата добавления: 2014-12-07; просмотров: 1067;
