Определите степень гидролиза (для первой ступени) и рН в 0,001М растворе и . Напишите уравнения реакций в молекулярном и ионном виде. 1 страница
77. Составьте ионно-молекулярное и молекулярное уравнение гидролиза, происходящего при смешивании растворов К2S и CrCl3.
78. К раствору FeCl3 добавили следующие вещества: а) HCl; б) КОН, в) ZnCl2; г) Na2CO3. В каких случаях гидролиз хлорида железа (III) усилится? Почему? Составьте ионно-молекулярное уравнение гидролиза соответствующих солей.
79. Какие из солей – Al2(SO4), K2S, Pb(NO3)2, KCl – подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (больше или меньше 7) имеют растворы этих солей?
80. При смешивании FeCl3 и Na2CO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями.
81. К раствору Na2CO3 добавили следующие вещества: а) HCl; б) NaOH; в) Cu(NO3)2; г) К2S. В каких случаях гидролиз карбоната натрия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
82. Какое значение рН (больше или меньше 7) имеют растворы солей Na2S, AlCl3, NiSO4? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
83. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Pb(NO3)2, Na2CO3, Fe2(SO4)3. Какое значение рН (больше или меньше 7) имеют растворы этих солей?
84. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей СН3СООК, ZnSO4, Al(NO3)3. Какое значение рН (больше или меньше 7) имеют растворы этих солей?
85. Какое значение рН (7<рН<7) имеют растворы солей Na3PO4, K2S, CuSO4? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
86. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей CuCl2, Cs2CO3, Cr(NO3)3. Какое значение рН (больше или меньше 7) имеют растворы этих солей?
87. К раствору Al2(SO4)3 добавили следующие вещества: а) H2SO4; б) КОН; в) Na2SO3; г) ZnSO4. В каких случаях гидролиз сульфата алюминия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
88. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2CO3 или Na2SO3; FeCl3 или FeCl2? Почему? Составьте ионно-молекулярные уравнения гидролиза этих солей.
89. При смешивании растворов Al2(SO4)3 и Na2CO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Составьте ионно-молекулярные и молекулярные уравнения происходящего совместного гидролиза.
90. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: NaCN или NaClO; MgCl2 или ZnCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей.
91. Составьте ионно-молекулярное и молекулярное уравнения гидролиза соли, раствор которой имеет: а) щелочную реакцию; б) кислую реакцию.
92. При смешивании растворов Al2(SO4)3 и Na2S каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями.
93. На полное умягчение 500 мл воды израсходовали 0,53 г соды. Определить жесткость воды.
94. Жесткость воды обусловлена содержащимися в ней хлоридами кальция и магния. При действии на 5 л воды раствором, содержащим 5,3 г соды, образовалось 4,52 г карбонатов кальция и магния. Определить жесткость воды и массы хлоридов кальция и магния в исходном растворе.
95. Карбонатная жесткость воды равна 20 ммоль экв/л. При кипячении 60 л этой воды выделилось 54,2 г осадка – смеси карбоната кальция и карбоната гидроксомагния. Определить массовый состав осадка.
96. Определить жесткость воды, в 20 л которой содержится 4,44 г хлорида кальция.
97. Сколько граммов гидроксида кальция необходимо прибавить к 100 л воды, чтобы удалить временную жесткость, равную 2,86 ммоль экв/л?
98. Вычислите временную жесткость воды, зная, что на реакцию с гидрокарбонатом, содержащимся в 100 мл этой воды, потребовалось 5 мл 0,1Н раствора соляной кислоты.
99. Чему равна временная жесткость воды, в 1 л которой содержится 0,146 г гидрокарбоната магния?
100. Жесткость воды, содержащей только гидрокарбонат кальция, равна 1,785 ммоль экв/л. Определите массу гидрокарбоната в 1 л воды.
101. Сколько карбоната натрия надо добавить к 5 л воды, чтобы устранить общую жесткость, равную 4,6 ммоль экв/л?
102. В 1 литре воды содержится 38 мг ионов Mg2+ и 108 мг ионов Са2+. Вычислите общую жесткость воды.
103. Карбонатная жесткость воды равна 15 ммоль экв/л. Определите массы гидрокарбонатов кальция и магния в 10 л воды, если на их полное осаждение израсходовали 23,68 г гидроксида кальция.
104. При умягчении 1 л воды израсходовали 0,53 г соды. Определить жесткость воды.
105. Карбонатная жесткость воды равна 20 мэкв/л. При кипячении 50 л воды выделилось 27,0 г осадка – смеси карбоната кальция и карбоната гидроксомагния. Определить массовый состав осадка.
106. При осаждении карбонатов из 1 л воды израсходовали 0,265 г соды. Определите жесткость воды.
107. Определите жесткость воды, в 5 л которой содержится 2,22 г хлорида кальция.
108. Найдите временную жесткость воды, если на титрование 0,1 л образца воды, содержащей гидрокарбонат магния, израсходовано 7,2 мл 0,13 н. HCl.
109. Для устранения общей жесткости по известково-содовому методу к 50 л воды добавлено последовательно 7,4 г Са(ОН)2 и 5,3 г Na2CO3. Рассчитайте временную и постоянную жесткость воды.
110. Вычислите обменную емкость сульфоугля, если через адсорбционную колонку, содержащую 50 г сульфоугля, пропущено 11,35 л воды с общей жесткостью 8,5 ммоль экв/л.
111. Чему равна жесткость воды, содержащей 0,005 моль/л CaCl2?
112. Напишите уравнение окислительно-восстановительной реакции, подберите коэффициенты, составив ионно-электронный баланс: 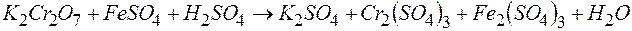 .
.
113. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? Какое свойство проявляет нитрит калия в данной реакции? Напишите уравнение окислительно-восстановительной реакции, составив ионно-электронный баланс:
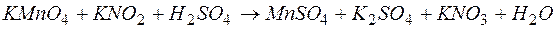 .
.
114. Закончите следующее уравнение окислительно-восстановительной реакции, подберите коэффициенты, составив ионно-электронный баланс: 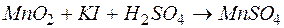 …
…
115. Исходя из степени окисления хрома в молекуле дихромата натрия, определите, какими свойствами обладает данное соединение. Напишите окислительно-восстановительную реакцию, составив ионно-электронный баланс: 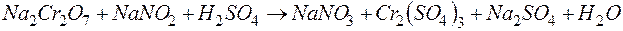 .
.
116. Составьте ионно-электронные уравнения и на основании их подберите коэффициенты в уравнениях следующих реакций:
а) 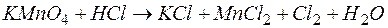 ;б)
;б) 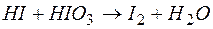
117. Исходя из степени окисления серы в сульфиде железа и азота в азотной кислоте, определите, какое вещество является окислителем, какое восстановителем, составьте ионно-электронные уравнения и расставьте коэффициенты в следующей реакции:
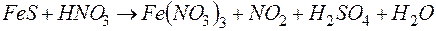 .
.
118. Напишите окислительно-восстановительную реакцию, подберите коэффициенты, составив ионно-электронный баланс. Какие свойства проявляет нитрит калия в данном процессе:
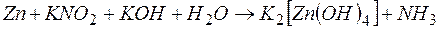 .
.
119. Составьте ионно-электронные уравнения и подберите коэффициенты для следующих окислительно-восстановительных реакций: а) 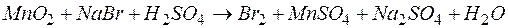 ;
;
б) 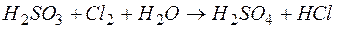 .
.
120. Исходя из степеней окисления серы, азота, определите, какими свойствами обладают вещества, участвующие в приведенных ниже окислительно-восстановительных реакциях. Составьте ионно-электронные уравнения, подберите коэффициенты:
а) 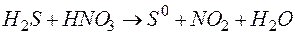 ; б)
; б) 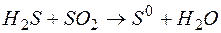 .
.
121. Закончите уравнения реакций внутримолекулярного окисления-восстановления, подобрав коэффициенты:
а) 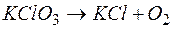 ; б)
; б) 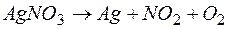 .
.
122. Составьте уравнения реакций диспропорционирования: а) 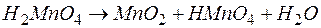 ; б)
; б) 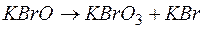 .
.
123. Закончите уравнения реакции внутримолекулярного окисления-восстановления, подобрав коэффициенты у реагирующих веществ: а) 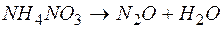 ; б)
; б) 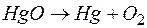 .
.
124. Напишите уравнение реакции взаимодействия, подберите коэффициенты методом электронно-ионного баланса в окислительно-восстановительной реакции между иодидом калия и пероксидом водорода, если при этом образуются молекулярный йод и едкое кали.
125. Напишите окислительно-восстановительную реакцию, составьте ионно-электронный баланс, определите молярную массу эквивалента восстановителя:
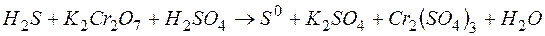 .
.
126. Определите молярную массу эквивалента окислителя, написав окислительно-восстановительную реакцию электронно-ионным методом:
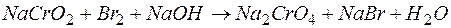 .
.
127. Сколько литров хлора (н.у.) можно получить из 200,0 г поваренной соли, если реакция идет по уравнению:
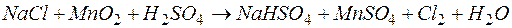 .
.
128. Какой объем 0,2Н раствора 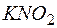 необходим для восстановления 0,05 л 0,1Н раствора
необходим для восстановления 0,05 л 0,1Н раствора 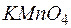 в кислой среде? Реакция идет по уравнению:
в кислой среде? Реакция идет по уравнению:
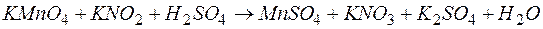 .
.
129. Какая масса сульфита натрия 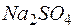 потребуется для восстановления 0,05 л 0,1Н раствора перманганата калия в присутствии серной кислоты? Реакция взаимодействия веществ протекает по уравнению:
потребуется для восстановления 0,05 л 0,1Н раствора перманганата калия в присутствии серной кислоты? Реакция взаимодействия веществ протекает по уравнению: 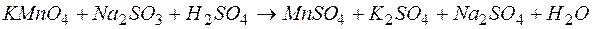 .
.
130. К подкисленному раствору иодида калия 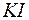 добавили 0,04 л 0,03Н раствора нитрита калия
добавили 0,04 л 0,03Н раствора нитрита калия 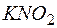 . Вычислите массу выделившегося йода и объем
. Вычислите массу выделившегося йода и объем 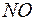 (н.у.), если реакция протекает по уравнению:
(н.у.), если реакция протекает по уравнению:
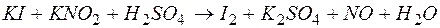 .
.
131. Напишите уравнение реакции, составив ионно-электронный баланс. Рассчитайте ЭДС, используя величины Red–Ox-потенциалов:
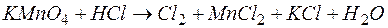
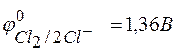 ;
; 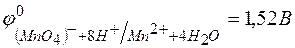 .
.
132. Составьте уравнение окислительно-восстановительной реакции, на основании ионно-электронного баланса подберите коэффициенты, рассчитайте ЭДС и определите возможность протекания реакции, пользуясь величинами Red–Ox-потенциалов:
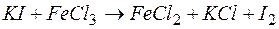
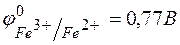 ;
; 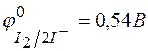 .
.
133. В каком направлении будет протекать реакция 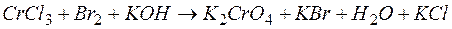 , если
, если 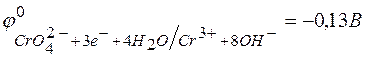 ;
; 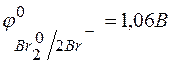 .
.
134. Возможна ли реакция между 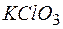 и
и 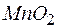 в кислой среде, если
в кислой среде, если 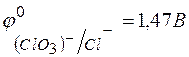 ;
; 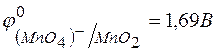 ?
?
135. В каком направлении будет протекать реакция
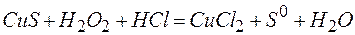 , если
, если
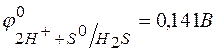 ;
; 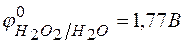 ?
?
136. Можно ли использовать перманганат калия 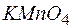 в качестве окислителя в следующих процессах при стандартных условиях, если
в качестве окислителя в следующих процессах при стандартных условиях, если 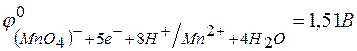 : а)
: а) 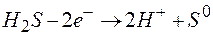 ;
; 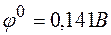 ;
;
б) 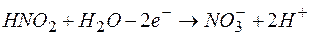 ;
; 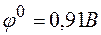 ;
;
в) 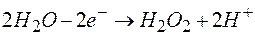 ;
; 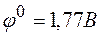 ?
?
137. Можно ли при стандартных условиях окислить в щелочной среде 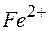 в
в 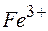 с помощью хромата калия
с помощью хромата калия 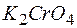 , если
, если
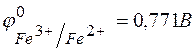 ;
; 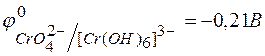 ?
?
138. Будет ли при стандартных условиях протекать следующая реакция: 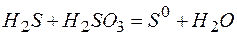 , если величины энергии Гиббса для реагирующих веществ следующие:
, если величины энергии Гиббса для реагирующих веществ следующие:
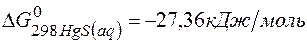 ;
; 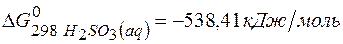 ;
;
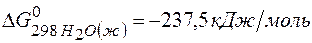 ?
?
139. Можно ли при стандартных условиях окислить хлороводород до хлора 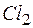 с помощью серной кислоты, если
с помощью серной кислоты, если
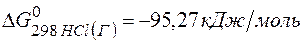 ;
; 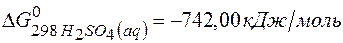 ;
; 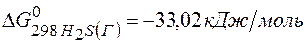 ;
; 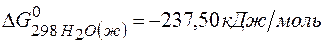 ?
?
140. Какой из окислителей: 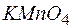 ,
, 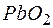 или
или 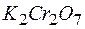 лучше всего использовать для получения хлора из
лучше всего использовать для получения хлора из 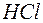 ? Стандартные Red – Ox-потенциалы равны:
? Стандартные Red – Ox-потенциалы равны:
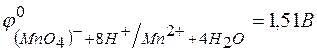 ;
; 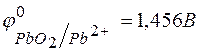 ;
; 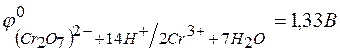 ;
; 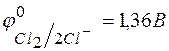 .
.
141. Составьте уравнения реакций: а) получения гидрида калия; б) взаимодействия гидрида калия с водой. Какой газ и в каком объеме получится при взаимодействии 5,3 г гидрида калия с водой?
142. Пропуская водяной пар над раскаленным углем, получают водяной газ. Какой объем водяного газа (н.у.) можно получить из 2,5 кг угля, содержащего 30% примесей?
143. Какой объем водорода, измеренный при 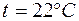 и
и 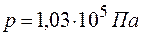 , необходимо затратить для получения 3,55 г молибдена из молибденового ангидрида
, необходимо затратить для получения 3,55 г молибдена из молибденового ангидрида 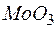 ?
?
144. Составьте уравнения реакций взаимодействия пероксида водорода: а) с дихроматом калия в кислой среде; б) с хромитом натрия в щелочной среде.
145. К подкисленному водному раствору иодида калия добавили 50 г водного раствора пероксида водорода. В результате реакции выделилось 20 г йода. Каково содержание (%) пероксида водорода в растворе?
146. Колба вместимостью 0,75 л, наполненная кислородом, при 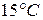 имеет массу 115,0 г. Масса пустой колбы 111,5 г. Определите давление газа в колбе.
имеет массу 115,0 г. Масса пустой колбы 111,5 г. Определите давление газа в колбе.
147. Какими химическими свойствами обладает озон? Закончите уравнения реакций: а) 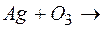 …; б)
…; б) 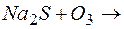 …; в)
…; в) 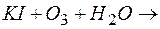 …
…
148. Как можно получить озон из кислорода? Какова объемная доля (%) озона в озонированном кислороде, если после разложения озона объем озонированного кислорода увеличился на 5%?
149. Какая масса раствора с массовой долей 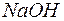 2% необходима для получения 63,3 л дифторида кислорода?
2% необходима для получения 63,3 л дифторида кислорода?
150. Сколько литров кислорода можно получить из 0,75 кг пероксида натрия при действии на него диоксида углерода?
151. Закончите уравнения химических реакций:
а) 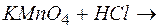 …; б)
…; б) 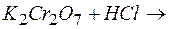 …; в)
…; в) 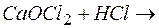 …
…
К каждой из реакций составьте электронно-ионную схему и рассчитайте ЭДС.
152. Сколько граммов белильной извести 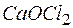 может быть получено, если через раствор, содержащий 1,7 г гашеной извести, пропустить 5,6 л хлора?
может быть получено, если через раствор, содержащий 1,7 г гашеной извести, пропустить 5,6 л хлора?
153. Составьте уравнения реакций, которые надо провести, чтобы осуществить превращения:
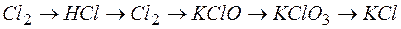 .
.
154. Какие продукты образуются при разложении 1,23 г бертолетовой соли по двум возможным вариантам (в присутствии катализатора и без катализатора) и какова их масса?
155. Какова массовая доля 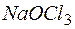 (%) в растворе, если 0,15 кг раствора
(%) в растворе, если 0,15 кг раствора 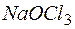 , реагируя с избытком иодида калия в сернокислом растворе, образует 0,013 кг йода?
, реагируя с избытком иодида калия в сернокислом растворе, образует 0,013 кг йода?
156. Сколько литров фтора надо пропустить через раствор 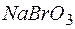 в щелочной среде, чтобы получить 0,05 кг
в щелочной среде, чтобы получить 0,05 кг 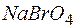 . Вычислите молярную массу эквивалента восстановителя в этой реакции.
. Вычислите молярную массу эквивалента восстановителя в этой реакции.
157. Реакции выражаются схемами:
а) H2S + Cl2 + H2O → H2SO4 + HCl;
б) K2Cr2O7 + H2S + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
158. Реакции выражаются схемами: а) KClO3 + Na2SO3 → KCl + Na2SO4; б) KMnO4 + HBr → Br2 + KBr + MnBr2 + H2O. Составьте электронно-ионные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
159. Могут ли происходить окислительно-восстановительные реакции между веществами: а) PH3 и HBr; б) K2Cr2O7 и H3PO3; в) HNO3 и H2S? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: AsH3 + HNO3 → H3AsO4 + NO2 + H2O.
160. Реакции выражаются схемами: а)P+ HClO3 + H2O → H3PO4 + HCl; б) H3AsO3 +KMnO4 →H3AsO4 + MnSO4 + K2SO4 + H2O. Составьте электронно-ионные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите окислитель, восстановитель, процесс окисления и процесс восстановления.
161. Реакции выражаются схемами: а) NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O;б) FeS + HNO3 → Fe(NO3)2 + S + NO + H2O. Составьте электронно-ионные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
162. Реакции выражаются схемами: а) HNO3 + Zn → N2O + Zn(NO3)2 + H2O; б) FeSO4 + KClO3 + H2SO4 → Fe2(SO4)3 + KCl +H2O. Составьте электронно-ионные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите окислитель, восстановитель, процесс окисления и процесс восстановления.
163. Реакции выражаются схемами: а) K2Cr2O7 + HCl → Cl2 + CrCl3 + KCl +H2O;б) Au + HNO3 + HCl → AuCl3 + NO + H2O. Составьте электронно-ионные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
164. Могут ли происходить окислительно-восстановительные реакции между веществами: а) NH3 и KMnO4; б) HNO2 и HI; в) HCl и H2Se? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O.
165. Реакции выражаются схемами: а) HCl + CrO3 → Cl2 + CrCl3 + H2O; б) Cd + KMnO4 + H2SO4 → CdSO4 + MnSO4 + K2SO4 + H2O. Составьте электронно-ионные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
166. Реакции выражаются схемами: а) Cr2O3 + KClO3 + KOH → K2CrO4 + KCl + H2O; б) MnSO4 + PbO2 + HNO3 → HMnO4 + Pb(NO3)2 + PbSO4 + H2O. Составьте электронно-ионные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
167. Реакции выражаются схемами: а) H2SO3 + HClO3 → H2SO4 + HCl; б) FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O. Составьте электронно-ионные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
168. Реакции выражаются схемами: а) I2 + Cl2 + H2O → HIO3 + HCl; б) K2Cr2O7 + H3PO3 + H2SO4 → Cr2(SO4)2 + H3PO4 + K2SO4 + H2O. Составьте электронно-ионные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите окислитель, восстановитель, процесс окисления и процесс восстановления.
169. Вычислите электродный потенциал 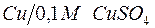 , если
, если 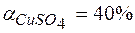 .
.
170. Определите величины потенциалов водородного электрода 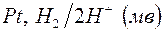 при следующих значениях
при следующих значениях 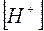 (в моль/л): 0,1; 0,01; 0,001; 0,0001; 0,00001.
(в моль/л): 0,1; 0,01; 0,001; 0,0001; 0,00001.
171. Вычертите кривую зависимости потенциала водородного электрода от концентрации ионов 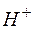 в растворе. Как изменяется величина этого потенциала по мере убывания кислотности приэлектродной жидкости (т.е. по мере уменьшения концентрации водородных ионов в ней)?
в растворе. Как изменяется величина этого потенциала по мере убывания кислотности приэлектродной жидкости (т.е. по мере уменьшения концентрации водородных ионов в ней)?
172. Вычислите потенциалы электродов:
а) 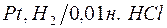 ; ;
| г) 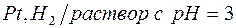 ; ;
|
б) 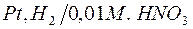 ; ;
| д) 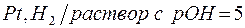 ; ;
|
в) 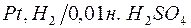 ; ;
| е) 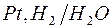 . .
|
173. Потенциал электрода 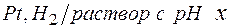 равен – 295 мв. Чему равен х?
равен – 295 мв. Чему равен х?
174. Потенциал электрода 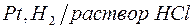 неизвестной концентрации равен – 118 мв. Определите нормальность раствора соляной кислоты.
неизвестной концентрации равен – 118 мв. Определите нормальность раствора соляной кислоты.
175. Потенциал электрода 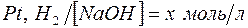 равен – 767 мв. Какова нормальность раствора едкого натра?
равен – 767 мв. Какова нормальность раствора едкого натра?
176. Гальванические цепи, представленные ниже в молекулярной форме, запишите в ионной форме:
а) 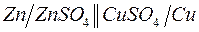 ;
;
б) 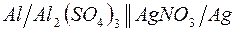 ;
;
Дата добавления: 2014-12-05; просмотров: 3743;
