Эмпирические и графические формулы солей
Графические формулы солей, по сравнению с другими классами неорганических соединений, имеют более сложное строение. Структура солей во многом базируется на графических формулах кислот и оснований, которые образовали данную соль.
При построении графических формул солей можно руководствоваться следующими правилами:
1) Элементы соединяются в соответствии с их валентностью.
2) Атомы кислорода в соединениях двухвалентны, атомы водорода – одновалентны.
3) Сначала в составе солей следует выделить центральный атом. Атомы водорода и металлов соединяются с центральным атомом через кислород. Если в молекуле содержится больше атомов кислорода, чем атомов водорода и металла, то оставшиеся атомы кислорода соединяются с центральным атомом двойной связью. Например:
Атом хлора в перхлорате калия KClO4 проявляет высшую валентность, равную семи. Тогда графическая формула этой соли будет иметь вид:
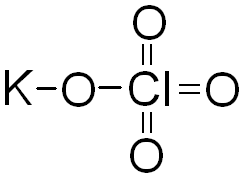
4) Если молекула имеет два центральных атома, то они соединяются между собой через атом кислорода, а остальные атомы распределяются поровну между центральными атомами. Например,
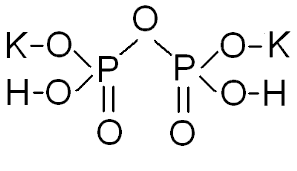
Соли имеют широкое практическое применение, поэтому получение солей является важной задачей химии. На практике возникают большие трудности, если в реакцию вступает многоосновная кислота и многокислотное основание. Чтобы решить данную задачу правильно, рассмотрим следующий пример.
Пример 9.Получите все возможные соли (среднюю, кислые и основные) при взаимодействии гидроксида алюминия и метакремниевой кислоты. Назовите все соли и постройте их графические формулы.
Решение: Эмпирические формулы исходных веществ: Al(OH)3 и H2SiO3. Их графические формулы:
Для нахождения эмпирических формул солей необходимо предварительно определить состав и заряды всех возможных кислотных остатков (анионов) и остатков оснований (катионов). Для этого необходимо написать диссоциацию кислоты и основания:
H2SiO3 ⇄ H+ + HSiO3- , Al(OH)3 ⇄ Al(OH)2+ + OH-,
HSiO3- ⇄ H+ + SiO32-. Al(OH)2+ ⇄ Al(OH)2+ + OH-,
Al(OH)2+ ⇄ Al3+ + OH-.
Таким образом, из метакремниевой кислоты и гидроксида алюминия можно получить четыре соли: кислую, среднюю и две основных. Схематично это можно представить следующим образом:
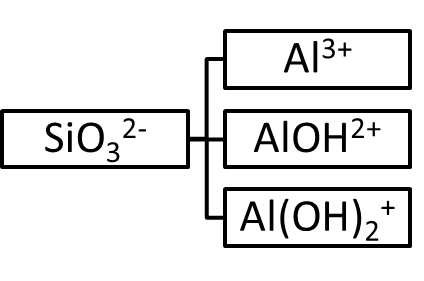
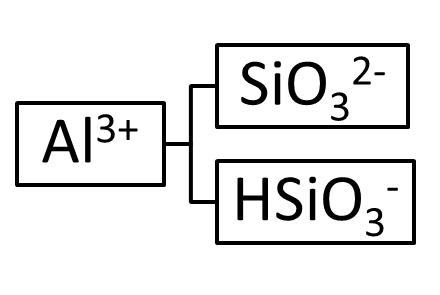
При составлении эмпирической формулы соли необходимо помнить, что ее молекула должна быть электронейтральной, т.е. суммарный заряд на катионе должен быть равен по абсолютной величине и противоположен по знаку суммарному заряду на анионе, например:
Сопоставляем по схеме катион Al3+ и SiO32-. Получим следующее равенство: Al3+ + SiO32- → AlSiO3. Однако формула средней соли AlSiO3 написана неверно, потому что суммарный заряд катиона и аниона равен +1. Чтобы привести его к нулю, необходимо найти минимальное необходимое число катионов и кислотных остатков. Для того можно воспользоваться методом подбора или поставить модуль заряда катиона как количество анионов, и наоборот.
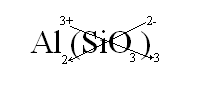
Следовательно, уравнение получения силиката алюминия из ионов Al3+ и SiO32- будет иметь следующий вид:
2Al3+ + 3SiO32- = Al2(SiO3)3.
Составим формулы кислой и основных солей по предложенной схеме:
Al3+ + 3HSiO3- = Al(HSiO3)3 ,
AlOH2+ + SiO32- = AlOHSiO3 ,
2Al(OH)2+ + SiO32- = (Al(OH)2)2SiO3 .
Для всех солей необходимо привести графические формулы и назвать их по традиционной номенклатуре:
Al2(SiO3)3 Al(HSiO3)3
силикат алюминия гидросиликат алюминия
AlOHSiO3 (Al(OH)2)2SiO3
силикат гидроксоалюминия силикат дигидроксоалюминия
Далее необходимо привести уравнения химических реакций получения солей и обязательно уравнять их:
2Al(OH)3 + 3 H2SiO3 = Al2(SiO3)3 + 6H2O;
Al(OH)3 + 3H2SiO3 = Al(HSiO3)3 + 3H2O;
Al(OH)3 + H2SiO3 = AlOHSiO3 + 2H2O;
2Al(OH)3 + H2SiO3 = (Al(OH)2)2SiO3 + 2H2O.
Получение солей
Соли получают при химическом взаимодействии соединений различных классов и простых веществ. Отметим важнейшие способы получения солей.
1) Взаимодействие кислот с основаниями (реакция нейтрализации):
H2SO4 + 2NaOH = Na2SO4 + 2H2O;
2HNO3 + Ba(OH)2 = Ba(NO3)2 + 2H2O.
2) Взаимодействие кислот с основными и амфотерными оксидами:
2HNO3 + СuO = Cu(NO3)2 + H2O;
2HNO3 + ZnO = Zn(NO3)2 + H2O.
3) Взаимодействие оснований с кислотными и амфотерными оксидами:
Ba(OH)2 + CO2 = BaCO3↓ + H2O;
2NaOH + PbO = Na2PbO2 + H2O (при сплавлении).
плюмбит натрия
4) Взаимодействие основных оксидов с кислотными и амфотерными оксидами:
CaO + SiO2 = CaSiO3;
CaO + SnO2 = CaSnO3.
3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl.
5) Взаимодействие металлов с неметаллами, кислотами, основаниями и солями:
2Fe + 3Cl2 = 2FeCl3, Zn + S = ZnS;
Fe + 2HCl = FeCl2 + H2↑;
Zn + 2KOH = K2ZnO2 + H2 ↑ (при сплавлении);
Fe + NiSO4 = FeSO4 + Ni.
6) Взаимодействие солей с солями:
К2SO4 + BaCl2 = BaSO4↓ + 2КCl
Кислые соли можно получить из средней при добавлении избытка кислоты или кислотного оксида, а основные соли – при избытке основания. Кислую соль можно перевести в среднюю соль при действии избытка основания на раствор кислой соли, а также при кипячении раствора кислой соли:
K2SO4 + H2SO4 = 2KHSO4 ;
CaCO3 + CO2 + H2O = Ca(HCO3)2 ;
Fe(OH)2 + HCl = FeOHCl + H2O;
KHSO4 + KOH = K2SO4 + H2O;
Ca(HCO3)2 = CaCO3 ↓ + CO2↑ + H2O.
Пример 10.Составьте уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
Mg → MgSO4 →Mg(OH)2 → MgO → MgCl2 → MgOHCl
Решение:
Mg + H2SO4 = MgSO4 + H2↑;
MgSO4 + 2NaOH = Mg(OH)2↓ + Na2SO4 ;
Mg(OH)2 = MgO + H2O (при прокаливании),
MgO + 2HСl = MgCl2 + H2O;
MgCl2 + NaOH = MgOHCl + NaCl.
Пример 11.Составьте уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
Cu → CuO → CuSO4 → Cu(HSO4)2 → Cu(OH)2 → CuOHCl → CuCl2
Решение: 2Cu + O2 = 2CuO (при нагревании);
CuO + H2SO4 = CuSO4 + H2O;
CuSO4 + H2SO4 = Cu(HSO4)2 ;
Cu(HSO4)2 + 4NaOH = Cu(OH)2↓ + 2Na2SO4 +2H2O;
Cu(OH)2↓ + HCl = CuOHCl + H2O;
CuOHCl + HCl = CuCl2 + H2O.
Дата добавления: 2019-04-03; просмотров: 3288;
