Классификация солей
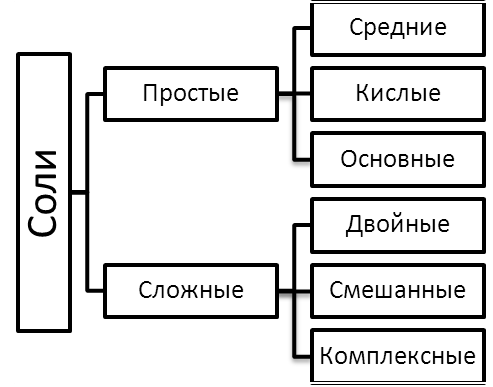
Рис. 5. Классификация солей
Соли делятся на простые и сложные, которые, в свою очередь, подразделяются на несколько видов (Рис. 5). Различают три вида простых солей: средние, кислые и основные.
1) Средние или нормальные соли, например, Na2SO4, Cu(NO3)2, Na3AsO4 следует рассматривать как продукты полного замещения атомов водорода в молекулах кислот на атомы металлов (или продукты полного замещения гидроксогрупп в основаниях на кислотные остатки). Такие соли получаются при взаимодействии кислоты и основания в эквивалентных количествах. Например:
H3PO4 + 3NaOH = Na3PO4 + 3H2O;
ортофосфат натрия
Cr(OH)3 + 2HCl = CrCl3 + H2O.
хлорид хрома (III)
2) Кислые соли образуют двух- и многоосновные кислоты при взаимодействии основания и избытка кислоты, например, NaH2PO4, NaНSO4, Cu(HСО3)2. Они являются продуктами неполного замещения атомов водорода в кислотах на атомы металлов, поэтому в своем составе содержат катионы водорода. Например:
H3PO4 + 2NaOH = Na2НPO4 + 2H2O,
гидроортофосфат натрия
H3PO4 + NaOH = NaН2PO4 + H2O.
дигидроортофосфат натрия
Избыток кислоты, взаимодействуя со средней солью, переводит ее в кислую, например, Са3(РО4)2 + H3PO4 = 3СаНРО4.
3) Основные соли – это продукты частичного, неполного замещения гидроксогрупп в основаниях кислотными остатками. Такие соли образуют двух- или многокислотные основания, при взаимодействии кислоты и избытка основания. Основные соли в своем составе содержат гидроксогруппу. Например:
Cr(OH)3 + 2HCl = CrOHCl2 + H2O;
хлорид гидроксохрома
Cr(OH)3 + 2HCl = Cr(OH)2Cl + H2O.
хлорид дигидроксохрома
Сложные соли.Это условное обозначение для солей, в которых катионы и анионы имеют более сложную структуру, чем у простых солей. К ним отнесены смешанные, двойные и комплексные соли.
1) Смешанными солями называют вид средних солей с двумя не соответствующими гидроксогруппе разновидностями кислотных остатков. В образовании таких солей участвуют один металл и две кислоты. Например: CaOCl2 – хлорид-гипохлорит кальция (хлорная известь). Диссоциация соли идет на один катион и анионы кислотных остатков соляной и хлорноватистой кислоты:
CaOCl2 → Са2+ + Cl- + ClO-.
2) Двойными солями называют вид средних солей, в которых присутствуют несколько разновидностей катионов отличных от водорода. Чаще всего в составе таких солей два катиона металла и один кислотный остаток. Например: КАI(SO4)2 – сульфат алюминия-калия (алюмокалиевые квасцы), KCr(SO4)2 сульфат хрома(III)-калия (хромкалиевые квасцы), (NH4)2Fe(SO4)2 – сульфат железа(II)-аммония (соль Мора). Такие соли диссоциируют на составляющие ионы – катионы металлов и кислотный остаток, следующим образом:
KCr(SO4)2 = K+ + Cr3+ + 2SO42- ;
(NH4)2Fe(SO4)2 = 2NH4+ + Fe2+ + 2SO42-.
Катионы в составе двойных солей комплементарны, т.е. структурно соответствуют молекулам, или участкам молекул, что приводит к формированию координационного соединения.
3) Комплексные (координационные) соли имеют в составе один или несколько сложносоставных ионов (при записи формул их заключают в квадратные скобки). Например: [Cu(NH3)4]Cl2 – хлорид тетраамминмеди (II), K[BiI4] – тетраиодовисмутат(III) калия, Na3[Al(OH)6] – гексагидроксоалюминат натрия.
Комплексные соли, в отличие от двойных и смешанных, диссоциируют на ионы внешней сферы, которые принято помещать в эмпирической формуле за пределами квадратных скобок, и комплексный ион, заключенный в квадратные скобки. Такая диссоциация проходит по типу сильных электролитов – сразу и полностью. Комплексный ион является устойчивой частицей и практически не распадается на составляющие его части. Например:
[Cu(NH3)4]Cl2 = [Cu(NH3)4]2+ + 2Cl- ;
Na3[Al(OH)6] = 3Na+ + [Al(OH)6]3-;
K[BiI4] = K+ + [BiI4]-.
Номенклатура солей
Вопрос номенклатуры солей стоит особо остро при изучении темы «Кассы неорганических соединений, потому что студенты часто путают технические (бытовые) названия солей с их традиционной номенклатурой (прил. 4).
Для названия солей наиболее распространенных кислот по традиционной номенклатуре составляется словосочетание из двух слов. Первое - является названием кислотного остатка в именительном падеже. Оно составляется из латинского корня в названии элемента образовавшего кислоту и окончания, соответствующего степени окисления центрального атома. Второе слово показывает металл в составе соли в родительном падеже. Если металл в составе соли имеет несколько степеней окисления, то она уточняется римской цифрой в скобках после названия металла.
Например: Натрий и калий в соединениях всегда имеют постоянную степень окисления, равную +1, поэтому NaCl – хлорид натрия, K2SO4 – сульфат калия, без указания степени окисления. Но Fe(NO3)2 – нитрат железа (II), Fe(NO3)3 – нитрат железа(III), так как у железа несколько степеней окисления, в данном случае Fe+2 и Fe+3.
Если кислота, образовавшая соль (среднюю, кислую или основную), имеет приставку мета-, орто-или пиро-, то при составлении названия соли приставка сохраняется. Например:
H3PO4 – ортофосфорная кислота → Li3PO4 – ортофосфат лития,
HAlO2 – метаалюминиевая кислота → Ca(AlO2)2 – метаалюминат кальция.
Соли бескислородных кислот называют по типу бинарных соединений. В названии аниона к латинскому корню элемента, образовавшего кислоту, добавляют окончание –ид,далее идет русское название металла. Например:
BaS – сульфид бария, CoF2 – фторид кобальта (II).
Названия солей кислородсодержащих кислот составляется из латинского корня от названия кислотообразующего элемента и окончания –ат, если степень окисления высшая, или окончания –ит, если степень окисления низшая. Например:
CrSO3 – сульфит хрома(II), степень окисления серы равна +4 (S+4);
CrSO4 – сульфат хрома(II), степень окисления серы равна +6 (S+6);
NaNO2 – нитрит натрия, степень окисления азота равна +3 (N+3);
NaNO3 – нитрат натрия, степень окисления азота равна +5 (N+5).
Если центральный атом в составе кислотного остатка имеет больше чем две степени окисления, то вводятся дополнительные приставки в названия солей:
- пер- , для обозначения высшей положительной степени окисления элементов седьмой группы. Например:
KMnO4 – перманганат калия, степень окисления марганца равна +7(Mn+7); NH4ClO4 – перхлорат аммония, степень окисления хлора равна +7 (Cl+7);
- гипо- , для обозначения низшей положительной степени окисления. Например:
KClO – гипохлорит лития,степень окисления хлора равна +1(Cl+1); NaH2PO2 – гипофосфит натрия, степень окисления фосфора равна +1 (P+1).
Так как кислые соли являются продуктами неполного замещения водорода в кислотах на металл, то при составлении их названия к названию кислотного остатка (перед приставками мета-, орто-, пиро-, если они есть) добавляется приставка гидро-,показывающая наличие не полностью замещенного водорода. Если не полностью замещенных атомов водорода два или более, то их число указывают названиями греческих числительных (2 - ди- , 3- три- и т.д.) см. таблицу 2.
Приставка моно-,в номенклатуре неорганических соединений используется крайне редко. В кислых и основных солях её использование допустимо, но не обязательно. Чаще её применяют в названиях комплексных и органических соединений. Например:
K3HSiO4 – гидроортосиликат калия,
K2H2SiO4 – дигидроортосиликат калия,
KH3SiO4 – тригидроортосиликат калия.
Основные соли представляют собой продукты неполного замещения гидроксогрупп в основаниях, поэтому при составлении названия таких солей необходимо указывать наличие и число гидроксогрупп –ОН. Однако, гидроксогруппа принадлежит не кислотному остатку, а катиону металла, поэтому приставка гидроксо-, добавляется к названию металла. Количество групп также показывается греческими числительными, также как и в кислых солях, перед приставкой гидроксо-. Например:
MnOH(NO3)3 – нитрат гидроксомарганца (IV),
Mn(OH)2(NO3)2 – нитрат дигидроксомарганца (IV),
Mn(OH)3NO3 – нитрат тригидроксомарганца (IV).
Диссоциация солей
С точки зрения теории электролитической диссоциации, соли это вещества, распадающиеся в водных растворах на катионы металлов и анионы кислотных остатков. Те из средних солей, что хорошо растворяются в воде, образуют растворы сильных электролитов, т.е. полностью диссоциируют в одну ступень. Например:
Na3PO4 = 3Na+ + PO43-.
Кислые и основные соли диссоциируют по ступеням из-за наличия не полностью замещенного водорода или не полностью замещенных гидроксогрупп.
Первичная диссоциация в кислых солях всегда сопровождается отщеплением катиона металла от сложного кислотного остатка, содержащего водород. Возможна дальнейшая ступенчатая диссоциация кислотного остатка, если соль образована слабой кислотой. Отщепление катионов водорода проходит по ступеням. Например:
KH2AsO4 = K+ + H2AsO4-, диссоциация по типу сильного электролита.
Дигидроарсенат-ион H2AsO4- является остатком слабой кислоты, поэтому будет диссоциировать по типу слабого электролита:
1ступень H2AsO4- ⇄ H+ + HAsO42- ,
2 ступень HAsO42- ⇄ H+ + AsO43-.
В основных солях кислотный остаток имеет свою обычную форму, но при диссоциации соли катион металла сохраняет свои гидроксогруппы. Возможна дальнейшая ступенчатая диссоциация – отщепление гидроксогрупп, если соль образована слабым основанием. ОН- отщепляются только по одной на каждую ступень. Например:
Cr(OH)2СI = Cr(OH)2+ + СI -, диссоциация по типу сильного электролита.
Cr(OH)2+ - остаток слабого основания, поэтому будет диссоциировать по типу слабого электролита:
1ступень Cr(OH)2+ ⇄ CrOH2+ + OH- ,
2 ступень CrOH2+ ⇄ Cr3+ + OH-.
Дата добавления: 2019-04-03; просмотров: 2532;
