Растворы кислот и оснований
При диссоциации кислот или оснований устанавливаются равновесия:
HAn ↔ H+ + An-, KatOH ↔ Kat+ + OH-,
где Kat+ – катион; An- – анион.
Процессу диссоциации соответствуют константы равновесия для кислот Ka (acid – кислота), а для оснований Kb (base – основание):
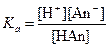 ,
,  .
.
Величины констант диссоциации приводятся в справочной литературе.
Для слабых электролитов (a®0) концентрация вещества в недиссоциированной форме примерно равна общей концентрации растворенного вещества. Согласно уравнению диссоциации концентрации катионов и анионов равны: [H+]= [An-]; [Kat+] = [OH-] (в результате единичного акта диссоциации получается один катион и один анион). Тогда константы диссоциации соответственно равны:
 ,
, 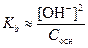 .
.
Из уравнений следует, что
 ,
, 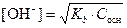 .
.
Соответственно раствор кислоты концентрацией Скисл моль/л имеет
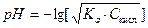 ,
,
а раствор основания концентрацией Сосн моль/л
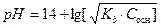 .
.
Концентрация ионов водорода и соответственно рН сильных кислот и оснований (a®1) рассчитывается, как правило, через степень диссоциации. Концентрации ионов водорода будут соответственно равны: в растворе кислоты [H+] = a×Cкисл, в растворе щелочи [OH–] = a×Cосн [H+] = 10–14/[OH–].
Таким образом, раствор кислоты концентрацией Скисл моль/л имеет
рН = –lg[a×Скисл],
а раствор основания концентрацией Сосн моль/л
pH = 14 + lg[a×Cосн].
Многоосновные кислоты и основания диссоциируют ступенчато, причем константа диссоциации каждой последующей ступени на несколько порядков меньше предыдущей. Поэтому расчет рН таких растворов обычно проводят по первой ступени диссоциации.
Буферные растворы
В водном растворе слабых кислот или оснований устанавливается равновесие, которому соответствуют равновесные значения концентраций ионов и недиссоциированных молекул:
HAn ↔ H+ + An-, KatOH ↔ Kat+ + OH-.
Изменение концентрации одного из ионов в растворе смещает равновесие. Изменение концентрации ионов H+ вызывается добавлением сильной кислоты, ионов ОH- – добавлением сильного основания, катионов металла (Kat+) и анионов кислот (An-) – добавлением растворимых солей, содержащих соответствующие ионы.
На практике большое значение имеют растворы, содержащие слабую кислоту или слабое основание и соль этой же кислоты или основания:
HAn + KatAn, KatOH + KatAn.
Они получили название буферные растворы, поскольку обладают свойством незначительно изменять величину pH при добавлении в них кислоты или щелочи. Это связано с тем, что рН этих растворов (равновесная концентрация ионов водорода) будет определяться концентрацией не только кислоты или основания, но и соли. Например, буферный раствор содержит слабую кислоту HAn (концентрация – Ск) и соль этой кислоты (концентрация – Сс). Концентрация ионов водорода определяется диссоциацией кислоты:
HAn ↔ H+ + An-, 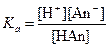 .
.
Поскольку в растворе присутствует соль, которая является сильным электролитом (a®1), то концентрация анионов в растворе будет определяться в основном анионами, получающимися в результате диссоциации соли, а не диссоциации слабой кислоты (a®0):
KatAn ↔ Kat+ + An-.
Поэтому можно считать, что концентрация анионов будет равна концентрации соли:
[An-] » Сс..
Поскольку [Н+]<<[An-], то равновесие смещено в сторону образования недиссоциированных молекул кислоты. Поэтому тем более можно считать, что их концентрация равна концентрации кислоты:
[HAn] » Ск .
Концентрация ионов водорода в буферном растворе будет зависеть от соотношения концентраций соли и кислоты:
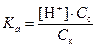 ®
® 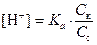 .
.
Добавление к буферному раствору кислоты или щелочи приводит к незначительному сдвигу установившегося в системе равновесия. Так, добавление ионов H+ ([H+]<<Cc) вызовет их дополнительную ассоциацию с анионами. При этом концентрация кислоты в недиссоциированной форме и концентрация соли изменятся слабо, соответственно практически не изменится величина pH. Добавленные ионы OH- ([ОH-]<<Cк) будут связываться ионами водорода (OH-+H+®H2О). Уменьшение их концентрации будет скомпенсировано в результате диссоциации слабой кислоты.
Аналогичные процессы протекают в буферных растворах, содержащих слабое основание и соответствующую соль. В этом случае концентрация ионов ОH- будет равна:
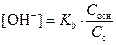 .
.
Очевидно, что количество сильной кислоты или основания, незначительно меняющих рН буферного раствора, ограничено. Характеристикой способности буферного раствора сохранять значение рН является емкость буфера, которая равна количеству кислоты или основания, необходимому для изменения pH раствора на единицу.
Гидролиз солей
Водные растворы солей являются электролитами, в которых молекулы соли практически полностью диссоциированы на ионы:
KatAn ® Kat+ + An-.
Катионы и анионы соли будут вступать во взаимодействие с ионами H+ и OH-, образовавшимися при диссоциации воды. Система придет в равновесие в результате установления равновесия в каждой реакции, которым будут соответствовать свои константы равновесия:
H+ + An-↔ HАn 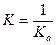 ,
,
Kat+ + OH-↔ KatOH 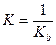 ,
,
H2O ↔ H+ + OH- KW.
В зависимости от величин констант диссоциации кислоты (Ка) и основания (Кb) равновесие в растворе будет смещено либо в сторону образования молекул кислот и оснований, либо в сторону образования ионов. Таким образом, если соль образована катионом слабого основания или анионом слабой кислоты, то суммарные уравнения реакций могут быть записаны в виде
Kat+ + H2O ↔ KatOH + H+ 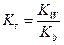 ,
,
An- + H2O ↔ HAn + OH- 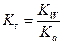 .
.
Реакции такого типа называются реакциями гидролиза солей. Им соответствуют константы равновесия (Кг), которые называются константами гидролиза.
Гидролиз приводит к изменению химического состава раствора. В нем, кроме катионов и анионов соли, будут присутствовать молекулы слабых кислот и оснований. Гидролиз солей образованных многоосновными кислотами или многокислотными основаниями протекает ступенчато. В этом случае в растворе будут присутствовать также гидроанионы или гидроксокатионы. Константы гидролиза каждой последующей ступени будут много меньше, чем предыдущей. Поэтому, как правило, описание гидролиза можно ограничить первой ступенью.
Аналогично степени диссоциации используют понятие степень гидролиза как доли количества молекул соли, подвергшихся гидролизу ( 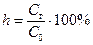 ). Как и степень диссоциации, степень гидролиза растет при уменьшении концентрации соли.
). Как и степень диссоциации, степень гидролиза растет при уменьшении концентрации соли.
Гидролизу подвержены все соли, образованные с участием ионов слабых электролитов. В большей степени гидролизуются соли, образованные одновременно катионом слабого основания и анионом слабой кислоты. Так же ему способствует вывод из реакционного объема продуктов (образование газа или осадка).
Как видно из приведенных уравнений, гидролиз изменяет рН раствора. Раствор соли, образованной катионом слабого основания и анионом сильной кислоты, в результате гидролиза приобретает кислый характер среды (pH<7). В случае катиона сильного основания и аниона слабой кислоты раствор соли имеет щелочной характер (pH>7).
Пример.
1. Соли, образованные катионом сильного основания и анионом сильной кислоты: NaCl, KNO3, K2SO4, … Гидролиза не происходит, pH=7.
2. Соли, образованные катионом слабого основания и анионом сильной кислоты: CuSO4, NH4Cl, Co(NO3)2, …
Cu2+ + H2O ↔ CuOH+ + H+ pH<7,
2 CuSO4+ 2 H2O ↔ [CuOH]2SO4 + H2SO4.
3. Соли, образованные катионом сильного основания и анионом слабой кислоты: Na3РO4, KCN, Na2CO3, …
РO43- + H2O ↔ HРO42-+ OH- pH>7,
Na3РO4+ H2O ↔ Na2HРO4+ NaOH.
4. Соли, образованные катионом слабого основания и анионом слабой кислоты: Al2S3, NH4NO2, Ag2CO3…
Al3++ H2O↔AlOH2+ + H+ ® AlOH2++ H2O↔Al(OH)2+ + H+ ®
Al (OH)2++ H2O↔Al(OH)3¯ + H+
S2- + H2O ↔ HS-+ OH- ® HS-+ H2O ↔ H2S + OH-
Al2S3 + 6 H2O ↔ 2 Al(OH)3¯+ 3 H2S pH »7.
Если известна молярная концентрация соли (Cc) и константы диссоциации слабой кислотs (Ка) или основания (Кb), то можно оценить величину pH раствора соли и степень гидролиза (h).
Kat++H2O↔KatOH+H+ 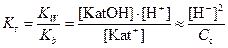
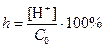 ,
,
An-+H2O↔HAn+OH- 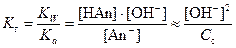
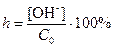
Пример. Оценить pH раствора CuSO4 Cc = 0,1 моль/л, Кb2=2,19∙10-7
Cu2+ + H2O ↔ CuOH+ + H+ pH<7,
2 CuSO4+ 2 H2O ↔ [CuOH]2SO4 + H2SO4.
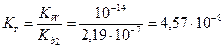 →
→ 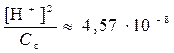 →
→ 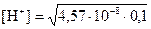 → [H+] = 6,76∙10-5 моль/л →
→ [H+] = 6,76∙10-5 моль/л →
pH = –lg[H+] = –lg (6,76∙10-5) = 4,17
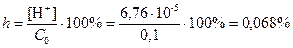
Дата добавления: 2017-02-20; просмотров: 2639;
