Кинетические уравнения реакций
Кинетическое уравнение необратимой реакции первого порядка
Рассмотрим необратимую (одностороннюю) реакцию распада:
A ® B + D.
Кинетическое уравнение:
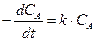 .
.
Начальные условия: концентрация вещества А в начальный момент времени (t =0) равна CA0.
Уравнения данного типа решаются методом разделения переменных:
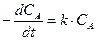 ®
® 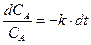 ®
® 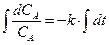 ,
, 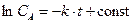 ,
,
при t =0; C = CA0 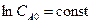 ,
, 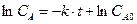 ,
,
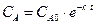 .
.

Рис. 6‑4 Изменение концентрации вещества А во времени при протекании односторонней реакции первого порядка (CA0=1)
Поскольку концентрация вещества А уменьшается в ходе реакции (рис.6.4) и асимптотически приближается к нулю, рассчитать точно время полного превращения вещества А невозможно. Для оценки времени протекания реакции используется такая характеристика, как время полупревращения (полураспада) – время, за которое прореагировала половина исходного вещества, т. е. концентрация вещества А уменьшилась в два раза ( 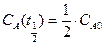 ):
): 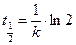 . Время полупревращения для реакций первого порядка не зависит от исходной концентрации вещества, а определяется только величиной константы скорости.
. Время полупревращения для реакций первого порядка не зависит от исходной концентрации вещества, а определяется только величиной константы скорости.
Кинетическое уравнение необратимой реакции второго порядка.
К необратимым реакциям второго порядка относятся химические реакции типа:
A + A ® A2, A + B ® AB, A + BС ® AB + С.
Рассмотрим как наиболее простую первую реакцию. Ее кинетическое уравнение имеет вид
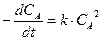 .
.
Начальные условия: концентрация вещества А в начальный момент времени (t =0) равна cA0:
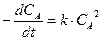 ,
, 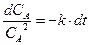 ,
, 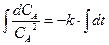 ,
, 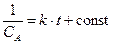 ,
,
при t =0; С = СA0 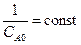 ,
, 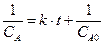 ,
,
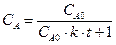 .
.

Рис. 6‑5 Изменение концентрации вещества А во времени при протекании реакции второго порядка (CA0=1)
Зависимость концентрации вещества от времени для реакций второго порядка (рис. 6.5) линейна в координатах 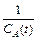 – t, причем тангенс угла наклона равен константе скорости реакции.
– t, причем тангенс угла наклона равен константе скорости реакции.
Время полупревращения для реакций второго порядка зависит от исходной концентрации вещества А: 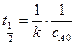 .
.
Реакции нулевого порядка.
Скорость реакций нулевого порядка не зависит от концентраций реагентов и определяется другими лимитирующими факторами, например площадью поверхности катализатора (в реакциях гетерогенного катализа) или поглощением света (в фотохимических реакциях):
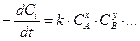 , x+ y +…=0.
, x+ y +…=0.
Кинетическое уравнение реакций нулевого порядка имеет вид
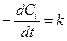 .
.
Изменение концентрации реагирующих веществ во времени будет описываться уравнением
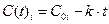 .
.
Время полупревращения 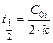 .
.
Кинетическое уравнение обратимой реакции первого порядка.
Изменение концентрации исходных веществ и продуктов реакции во времени в случае протекания обратимой (двусторонней) реакции можно показать на примере реакции первого порядка: А↔В.
Согласно закону действующих масс скорость прямой и обратной реакций будут описываться уравнениями
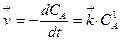 ,
, 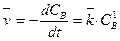 .
.
Изменение концентраций исходного вещества А и продукта В определяется разностью скоростей прямого и обратного процессов:
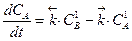 ,
, 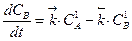 .
.
Кинетические уравнения содержат три переменные: CA,CB и t. Для интегрирования одну необходимо исключить. Это можно сделать на основе материального баланса. Пусть в начальный момент времени при t=0 концентрация исходного вещества А равняется C0A, а концентрация продукта В – C0B, к моменту времени t согласно уравнению реакции концентрации реагентов изменятся на величину x: CA = CA0 – x, CB= CB0 + x.
Тогда 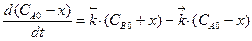 ,
, 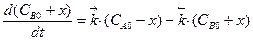 ,
,
и соответственно 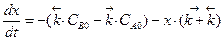 .
.
Учитывая, что при t=0 x=0, решением уравнения будет:
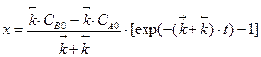 .
.
| |
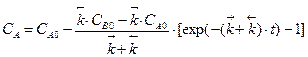 ,
,
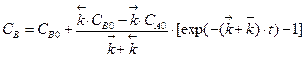 .
.
Изменение концентрации веществ А и В во времени приведено на рис.6.6.

 Рис. 6‑6 Изменение концентрации веществ А и В во времени при протекании обратимой реакции первого порядка А↔В.
Рис. 6‑6 Изменение концентрации веществ А и В во времени при протекании обратимой реакции первого порядка А↔В.  ; C0A=1; C0B=0
; C0A=1; C0B=0
Рис. 6‑7 Изменение во времени скоростей прямой и обратной реакций первого порядка А↔В:  ; C0A=1; C0B=0
; C0A=1; C0B=0
По достижении равенства скоростей прямой и обратной реакции (рис.6.7) концентрации исходного вещества и продукта изменяться не будут (в данном примере САр=0,167; СВр=0,833), система придет в состояние равновесия.
Кинетические уравнения последовательных и параллельных реакций.
Принцип независимости протекания реакций заключается в том, что если в системе происходит несколько элементарных реакций, то каждая из них протекает по тем же законам, как и в отсутствии других реакций. Следовательно, если в нескольких реакциях участвует одно и то же вещество, то изменение его концентрации будет равно алгебраической сумме скоростей каждой реакции, умноженной на стехиометрический коэффициент этого вещества в данной реакции.
В случае последовательных реакций вещество, образующееся в первой реакции, является исходным для другой. Например, последовательная односторонняя реакция первого порядка:

Система кинетических уравнений для нее будут иметь вид:
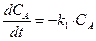 ,
, 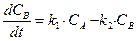 ,
, 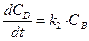 .
.
Результаты численного решения уравнений приведены на рис.6.8.

Рис. 6‑8 Зависимость концентрации исходного (CA) промежуточного (CB) и конечного (CD) веществ от времени для последовательной односторонней реакции первого порядка (k1 = 0,5; k2 = 0,3; C0A=1).
 В случае параллельных реакций одно вещество является исходным для нескольких реакции. Например, две реакции первого порядка:
В случае параллельных реакций одно вещество является исходным для нескольких реакции. Например, две реакции первого порядка:
Система кинетических уравнений в этом случае будет иметь вид:
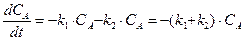
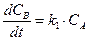

Аналогичным образом составляется система дифференциальных кинетических уравнений и для более сложных реакций. Например, параллельно-последовательные, с реакциями, как первого, так и второго порядков:

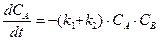
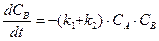
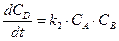
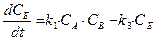
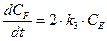 .
.
Такие системы уравнений решают, как правило, численными методами.
Дата добавления: 2017-02-20; просмотров: 990;
