Константа скорости химической реакции
Вероятность образования новых молекул при встрече частиц исходных веществ будет зависеть от процесса перестройки их электронных оболочек. Необходимым условием этого является возможность перекрывания электронных орбиталей атомов с разрывом старых и образованием новых связей, которая не всегда может быть реализована вследствие геометрического строения взаимодействующих частиц. Например, для того чтобы произошел элементарный акт бимолекулярной химической реакции A + B®АВ, расстояние между частицами A и B и их взаимная ориентация должны стать такими, чтобы была возможна перестройка их электронных оболочек.
Перекрывание электронных орбиталей осуществляется в процессе сближения частиц. При этом увеличиваются как энергия притяжения, так и энергия отталкивания. Изменение соотношения величин этих энергий в зависимости от расстояния между частицами может привести к возникновению энергетического барьера, преодоление которого является необходимым условием осуществления элементарного акта. Поэтому для многих реакций имеется минимальная пороговая энергия, получившая название энергии активации (Еак), которой должны обладать встретившиеся частицы, для того чтобы произошла химическая реакция. Основным источником энергии для преодоления этого энергетического барьера является кинетическая энергия теплового движения частиц, которая зависит от температуры. Поэтому вероятность осуществления элементарного акта (константа скорости реакции) будет зависеть от температуры.
Сванте Аррениус (Arrhenius) предложил описывать температурную зависимость константы скорости реакции уравнением
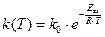 ,
,
где k0 – предэкспоненциальный множитель; Еак – энергия активации; R –универсальная газовая постоянная; Т – температура (К).
На практике для большинства реакций в небольшом температурном интервале предэкспоненциальный множитель и энергия активации считаются постоянными величинами, не зависящими от температуры.
Теория элементарных химических реакций определяет физический смысл этих констант и позволяет рассчитывать их величины. Существуют две основные модели описания элементарного акта реакции:теория активных соударений и теория переходного состояния.
Теория активных соударений.
Применение молекулярно-кинетической теории газов к описанию элементарной химической реакции позволило создать теорию активных соударений, в которой раскрывается физический смысл предэкспоненциального множителя в уравнении Аррениуса.
Согласно этой теории скорость бимолекулярной химической реакции определяется числом столкновений молекул за единицу времени, причем не все столкновения приводят к образованию новой молекулы, а только те, при которых кинетическая энергия исходных частиц больше энергии активации реакции. Каждое такое активное соударение приводит к осуществлению элементарного акта.
При протекании элементарной бимолекулярной химической реакции A + B ® AB при температуре Т общее число столкновений молекул A и B в газе может быть рассчитано по уравнению
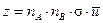 ,
,
где z – число соударений в единице объема в единицу времени; ni – число частиц в единице объема; 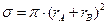 – сечение упругого соударения частиц с эффективными радиусами ri;
– сечение упругого соударения частиц с эффективными радиусами ri; 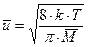 – средняя относительная скорость движения частиц;
– средняя относительная скорость движения частиц; 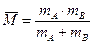 – средняя молекулярная масса частиц А и В; k – постоянная Больцмана. Таким образом,
– средняя молекулярная масса частиц А и В; k – постоянная Больцмана. Таким образом, 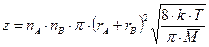 .
.
При переходе от числа частиц к числу молей соответствующих веществ в единице объема (молярные концентрации) получаем
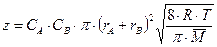 ,
,
где R = k×NA – универсальная газовая постоянная; NA – число Авогадро; Сi – молярная концентрация.
Пример. Определим общее число столкновений молекул H2 и Cl2 в 1 см3 смеси равных объемов газов при нормальных условиях.
Число частиц H2 и Cl2 в 1 см3 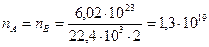 1/см3.
1/см3.
Относительная скорость частиц 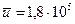 см/с.
см/с.
Сечение упругого соударения молекул s=1,1×10-14 см2.
Число соударений частиц H2 и Cl2 в 1 см3 за 1 секунду равно: 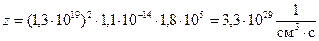 .
.
Поскольку к образованию новых молекул приводят только активные соударения, общее число соударений необходимо умножить на функцию f(Eaк), определяющую долю соударений частиц, обладающих энергией большей, чем энергия активации Еак:
za = z×f(Eaк).
Функцию f(Eaк) можно получить из закона распределения Максвелла - Больцмана. Доля молекул с энергией Е большей, чем энергия активации Eак (E>Eак), равна:
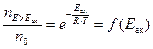 ,
,
где n0 – общее число молекул в системе; nE>Eак – число молекул, обладающих кинетической энергией большей, чем энергия активации.
Энергия активации реальных реакций, протекающих не слишком быстро и не слишком медленно, составляет величину порядка Еак ~ 50÷100 кДж/моль. С учетом этого при температурах близких к стандартным доля молекул, имеющих энергию больше, чем энергия активации, составляет величину порядка 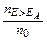 ~10-9÷10-18, т. е. доля столкновений частиц, приводящих к их взаимодействию, достаточно мала.
~10-9÷10-18, т. е. доля столкновений частиц, приводящих к их взаимодействию, достаточно мала.
Таким образом, число активных соударений в зависимости от температуры равно:
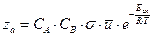 .
.
Для многих реакций важна геометрия столкновений. Сталкивающиеся активные молекулы должны быть соответствующим образом ориентированы относительно друг друга, чтобы обеспечить возможность осуществления элементарного акта взаимодействия. Геометрия столкновения учитывается множителем р, получившим название стерического фактора. Тогда число активных соударений с учетом стерического фактора (zа*) будет равно: zа*=p zа.
Поскольку каждое активное соударение приводит к образованию новой молекулы, то число активных соударений в единице объема в единицу времени (zа*) соответствует, по определению скорости химической реакции, числу элементарных актов взаимодействия в единицу времени в единице объема. Таким образом, zа*= v,
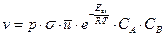 .
.
Согласно закону действующих масс, скорость химической реакции A + B ® AB равна: 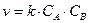 . Следовательно, константа скорости реакции k будет определяться выражением
. Следовательно, константа скорости реакции k будет определяться выражением
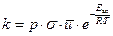 или
или 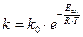 ,
,
где 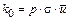 –предэкспоненциальный множитель.
–предэкспоненциальный множитель.
Произведение сечения упругих столкновений (s) на среднюю скорость движения молекул ( 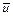 ) представляет собой частотный фактор (z0):
) представляет собой частотный фактор (z0):
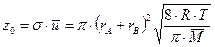 .
.
Величина z0 пропорциональна числу столкновений молекул в единице объема в единицу времени (числу соударений при единичных концентрациях частиц). Частотный фактор слабо зависит от температуры и может считаться величиной постоянной, которая может быть вычислена из молекулярно-кинетической теории газов.
Стерический фактор р учитывает ориентацию частиц в пространстве в момент столкновения по отношению друг к другу. При благоприятной ориентации для образования новых молекул р»1, при неблагоприятной ориентации р<1. Таким образом, k0=p×z0.
Теория активных соударений не позволяет рассчитать величину энергии активации. Дальнейшее развитие теории элементарных реакций связано с привлечением квантово-механического описания перестройки системы химических связей в молекулах реагирующих веществ.
Теория переходного состояния.
В элементарном акте химической реакции участвуют частицы исходных веществ, которые в ходе реакции превращаются в частицы продуктов. Этот переход осуществляется, как было отмечено ранее, через образование промежуточной нестабильной частицы, включающей в себя все атомы взаимодействующих частиц, объединенные общей системой химических связей. В процессе этого превращения изменяются расстояния между ядрами атомов, входящих в частицы. В модели адиабатического приближения каждому взаимному расположению ядер атомов соответствует одно определенное значение энергии, т. е. энергия системы будет определяться взаимным расположением атомов. Зависимость потенциальной энергии системы взаимодействующих частиц от их координат можно рассматривать как поверхность в многомерном пространстве – поверхность потенциальной энергии. Наиболее наглядно эту поверхность можно проиллюстрировать на примере бимолекулярной реакции АВ + С ® А + ВС, в элементарном акте которой принимают участие три атома.
В общем случае энергия трех взаимодействующих атомов зависит от расстояния между ними (rAB и rBC) и угла a. В элементарном акте угол a полагают постоянным (угол подлета частицы С к частице АВ), например, при столкновении частиц АВ и С по направлению линии связи a=180° (рис.6.1). В этом случае поверхность потенциальной энергии будет функцией двух переменных E(rAB, rBC). Построенная в декартовой системе координат поверхность потенциальной энергии показана на рис.6.2, а.
Рис. 6‑1 Пространственное расположение трех атомов при протекании элементарного акта бимолекулярной реакции АВ + С ® А + ВС (столкновении частиц по направлению линии связи a=180°).
В исходном состоянии энергия системы минимальна по отношению к расположению атомов в молекуле АВ (определяется rAB) и слабо зависит от другой координаты(rBC). На диаграмме (рис.6.2, а)этому состоянию соответствует долина исходных веществ. В конечном состоянии энергия системы минимальна по отношению к расположению атомов в молекуле ВС (rBC) и слабо зависит от другой координаты (rAB). На диаграмме этому состоянию соответствует долина продуктов. Элементарный акт химической реакции представляет собой переход системы из долины исходных веществ с долину продуктов. Энергетически выгодно, чтобы этот переход осуществлялся через точки минимумов на поверхности потенциальной энергии.

Рис. 6‑2 Поверхность потенциальной энергии реакции АВ + С ® А + ВС (а) и изолинии потенциальной энергии (б)
Этот переход (путь реакции) показан стрелкой на диаграмме потенциальной поверхности, изображенной на плоскости в виде системы линий, соединяющих точки с одинаковыми значениями потенциальной энергии (рис. 6.2, б). При движении из одной долины в другую энергия системы сначала возрастает, а затем уменьшается, система преодолевает перевал (точка P). Слева располагается «высокое» плато, которое соответствует состоянию системы из трех отдельных атомов А, В, С (одновременно rAB и rBC ® ∞). Справа поверхность «круто» поднимается вверх, поскольку одновременное уменьшение расстояний между атомами (rAB и rBC ® 0) приводит к резкому возрастанию энергии отталкивания атомов (рис. 6.2, а).
Состояние системы с максимальной энергией (точка P) называется переходным состоянием, которое соответствует образованию тремя атомами короткоживущего промежуточного соединения (активированного комплекса), обладающего повышенным запасом энергии. Таким образом, элементарная химическая реакция проходит через стадию образования активированного комплекса. Он представляет собой нестабильную молекулу, в состав которой входят все атомы исходных веществ и в которой старые химические связи еще полностью не разрушены, а новые еще полностью не образованы.
В рассматриваемой реакции система проходит через активированный комплекс (ABC)¹:
Все параметры, относящиеся к переходному состоянию (активированному комплексу), обозначаются верхним индексом ¹.
Если ввести понятие координаты реакции (X) – положение системы на пути перехода из начального состояния в конечное (рис.6.2, б), то изменение энергии системы в ходе элементарного акта будет представлять собой функцию одной переменной E(X). Вид этой зависимости представлен на энергетической диаграмме рис.6.3.
Максимум на диаграмме (точка P) соответствует переходному состоянию. Энергия активации реакции соответствует энергии образования активированного комплекса. Это энергия, которой должны обладать частицы, для того чтобы произошел элементарный акт химической реакции.

Рис. 6‑3 Диаграмма изменения энергии системы в ходе реакции АВ+С ® А+ВС
Необходимо отметить, что теория переходного состояния базируется на ряде допущений. Элементарный акт реакции проходит через образование активированного комплекса по пути преодоления самого низкого энергетического барьера. Расчет энергии активации проводится с использованием методов квантовой механики. Считается, что активированный комплекс (ABC)¹ представляет собой обычную молекулу, у которой одна колебательная степень свободы заменяется на поступательное движение вдоль координаты реакции (X). Система находится все время в состоянии термодинамического равновесия. Вероятность перехода активированного комплекса в продукты реакции определяется трансмиссионным коэффициентом c, который чаще всего равен единице.
 В теории переходного состояния химическую реакциюАВ + С ® А + ВС представляют двумя последовательными процессами:
В теории переходного состояния химическую реакциюАВ + С ® А + ВС представляют двумя последовательными процессами:
Исходные вещества и активированный комплекс находятся в состоянии равновесия, а продукты получаются в результате распада активированного комплекса.
Таким образом, скорость химической реакции АВ + С ® А + ВС будет определяться скоростью распада активированного комплекса: 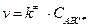 .
.
В теории переходного состояния константа скорости реакции распада активированного комплекса на продукты реакции определяется выражением 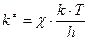 , где c – трансмиссионный коэффициент; k – константа Больцмана; h – постоянная Планка.
, где c – трансмиссионный коэффициент; k – константа Больцмана; h – постоянная Планка.
Концентрацию активированного комплекса можно определить через константу равновесия KC¹ реакции его образования из исходных молекул (см. раздел химическое равновесие):
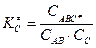 ,
, 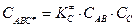 .
.
Тогда, скорость реакции АВ + С ® А + ВСбудет описываться выражением 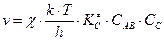 . Согласно закону действующих масс
. Согласно закону действующих масс 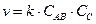 , следовательно, константа скорости реакции k будет
, следовательно, константа скорости реакции k будет
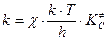 .
.
Константу равновесия можно определить через изменение термодинамических функций реакции образования активированного комплекса (реакция протекает при постоянных давлении и температуре). Поскольку 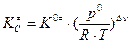 (в данном примере Dn= –1), а
(в данном примере Dn= –1), а
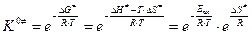 ,
,
где DG¹ – изменение энергии Гиббса; DH¹ – изменение энтальпии, которое и является фактически энергией активации; DS¹ – изменение энтропии при образовании активированного комплекса, то
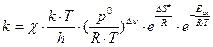 .
.
Сравнение уравнения Аррениуса и формулы для расчета константы скорости по теории переходного состояния:
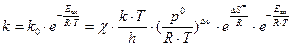
дает возможность оценить значение предэкспоненциального множителя (k0).
Дата добавления: 2017-02-20; просмотров: 1762;
