Определение кинетических параметров реакции
Основными кинетическими параметрами формально простой химической реакции являются порядок по компонентам, константа скорости и энергия активации реакции. Они определяются из экспериментальных зависимостей концентрации реагирующих веществ (или величин пропорциональных концентрации) от времени и температуры.
Для экспериментального определения порядка реакции (x и y в кинетическом уравнении) и константы скорости при конкретной температуре (k) обычно используют способ избыточных концентраций. Добавление в реакционную смесь в большом избытке всех реагирующих веществ, кроме одного, позволяет считать, что их концентрация в ходе реакции не меняется. Рассмотрим, например, реакцию nAA + nBB=nDD + nEE. Зависимость ее скорости от концентрации реагентов определяется уравнением
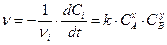 , x¹nA; y¹nB.
, x¹nA; y¹nB.
Если С0B>> C0A, то можно считать, что в ходе реакции концентрация вещества В не меняется(СB=С0B – const). Тогда
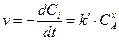 ;
; 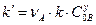 .
.
Это позволяет определить порядок реакции по компоненту А дифференциальным или интегральным методами.
Дифференциальный метод.Порядок реакции по компоненту Аи константу скорости рассчитывают по экспериментально определенной зависимости скорости реакции от концентрации вещества, не находящегося в избытке (v=f(CA)). Поскольку 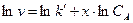 , то в координатах lnv –lnCA зависимость скорости реакции от концентрации вещества А будет представлять собой прямую линию (рис. 6.9). Причем тангенс угла наклона этой прямой равен x, а отрезок, отсекаемый на оси lnv, равен lnk¢.
, то в координатах lnv –lnCA зависимость скорости реакции от концентрации вещества А будет представлять собой прямую линию (рис. 6.9). Причем тангенс угла наклона этой прямой равен x, а отрезок, отсекаемый на оси lnv, равен lnk¢.

Рис. 6‑9 Дифференциальный метод определения порядка реакции по компоненту
Порядок реакции x может быть как целым, так и дробным. Экспериментальные точки должны ложиться на прямую в пределах ошибки измерений. Если это условие не выполняется, то реакция не является формально простой, и уравнение закона действующих масс для ее описания неприменимо.
Интегральный метод. Порядок реакции по компоненту А определяют по виду экспериментальной зависимости концентрации этого вещества от времени протекания реакции (CA=f(t)). Эта зависимость является линейной в координатах С–t для реакций нулевого порядка (рис. 6.10, а), lnC–t – первого (рис.6.10, б), 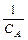 –t – второго порядка (рис.6.10, в).
–t – второго порядка (рис.6.10, в).

Рис. 6‑10 Изменение концентрации вещества А (CA) во времени t, если кинетическое уравнение имеет вид 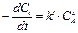 : а) – x=0; б) – x=1; в) – x=2
: а) – x=0; б) – x=1; в) – x=2
Тангенс угла наклона прямой в соответствующих координатах равен k¢. Если экспериментальные точки в соответствующих координатах не ложатся на прямую линию в пределах ошибки измерений, то порядок реакции не равен 0,1,2 и должен определяться другим способом.
Энергия активации химической реакции определяется из экспериментальной зависимости константы скорости (скорости реакции) от температуры. Поскольку 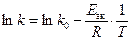 , то очевидно, что в координатах lnk–1/T зависимость константы скорости от температуры представляет собой прямую линию. Тангенс угла наклона прямой равен Eак/R (рис. 6.11).
, то очевидно, что в координатах lnk–1/T зависимость константы скорости от температуры представляет собой прямую линию. Тангенс угла наклона прямой равен Eак/R (рис. 6.11).

Рис. 6‑11 Зависимость логарифма константы скорости реакции (lnk) от обратной температуры (1/Т, К)
Дата добавления: 2017-02-20; просмотров: 1014;
