Ионные кристаллы. Ионный тип химической связи
Распространенным типом кристаллов являются кристаллы, образованные атомами с сильно различающимися значениями электроотрицательностей (cВ>>cА). В первом приближении можно считать, что в этом случае пара валентных электронов полностью смещается к атому В, при этом образуются ионы противоположного знака: А+ – катион и В- – анион. Данное допущение считается справедливым, если перенос заряда составляет величину более 2/3 от максимально возможной, что соответствует разности в значениях электроотрицательностей по Полингу более чем 2,1 ( 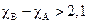 ).
).
Минимум энергии системы соответствует чередованию во всех направлениях в кристаллической решетке катионов и анионов. В данном случае химическую связь относят к ионному типу и ее описание сводится к определению энергии взаимодействия ионов, то есть электрических зарядов. В первом приближении ионы можно представить недеформирующимися шарами. Поскольку электрическое поле сферически симметрично, энергия взаимодействия определяется только расстоянием между зарядами, а не их взаимным расположением. Минимум энергии достигается в случае наименьшего расстояния между зарядами, что выполняется при одном из вариантов плотнейшей упаковки ионов. Энергия электростатического взаимодействия одного моля ионов в кристалле (энергия ионной связи) называется энергией кристаллической решетки.
Расчет энергии ионной кристаллической решетки.
Между катионом (A+) и анионом (B-) действуют силы электростатического притяжения и отталкивания. Энергия притяжения может быть описана законом взаимодействия точечных зарядов. Энергия отталкивания ближайших соседних ионов определяется взаимодействием системы точечных зарядов электронов и ядер и описывается более сложной зависимостью. Энергия взаимодействия пары ионов равна сумме энергии притяжения и энергии отталкивания: 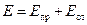 .
.
Энергия притяжения противоположных по знаку зарядов в зависимости от расстояния между ними определяется законом Кулона: 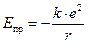 , где r – расстояние между центрами ионов, e – заряд электрона, k – константа в законе Кулона.
, где r – расстояние между центрами ионов, e – заряд электрона, k – константа в законе Кулона.
Энергию отталкивания Макс Борн (Born) предложил определять по формуле 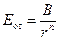 , где B − постоянная величина, n – коэффициент борновского отталкивания.
, где B − постоянная величина, n – коэффициент борновского отталкивания.
Таким образом, энергия двух взаимодействующих ионов в зависимости от расстояния между их центрами будет равна:
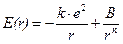 .
.
Энергия химической связи пары ионов (Eсв) соответствует минимуму энергии системы, который достигается на расстоянии между ионами, равном длине связи (r = rсв) (рис. 4.8).

Рис. 4‑8 Энергия взаимодействия пары ионов в зависимости от расстояния между ними
Постоянную B можно определить из условия равенства нулю первой производной функции в точке минимума:

 , →
, → 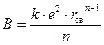 .
.
Тогда величина энергии химической связи пары ионов будет равна:
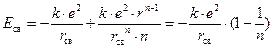 .
.
Для определения энергии кристаллической решетки необходимо учесть, что один моль вещества содержит NА (число Авогадро) пар ионов. Кроме того, необходимо учесть энергию взаимодействия каждого иона как с ближайшими, так и с более удаленными ионами. Вклад этого взаимодействия зависит от типа кристаллической решетки и учитывается с помощью множителя А, который называется постоянной Маделунга. Таким образом, энергия кристаллической решетки, образованной однозарядными ионами, определяется уравнением (уравнение Борна)
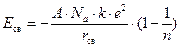 ,
,
где А – постоянная Маделунга, для кристаллической решетки типа NaCl (ГЦК) A=1,7475, типа CsCl (ПК) A=1,763; n – коэффициент борновского отталкивания определяется из сжимаемости кристалла – относительного уменьшения его объема при увеличении давления. Для галогенидов щелочных металлов n = 6÷12.
Реальные ионы в узлах кристаллической решетки не являются недеформирующимися шарами. Для более точного расчета величины энергии кристаллической решетки необходимо учитывать эффекты, связанные с деформацией ионов, которая приводит к разделению центров положительных и отрицательных зарядов, то есть при рассмотрении взаимодействия точечных зарядов необходимо учесть взаимодействие диполей. Вклад этих эффектов невелик и составляет единицы процентов.
Пример. Электростатическая модель для кристаллов галогенидов щелочных металлов (ЩГК) дает хорошее совпадение величин энергии кристаллической решетки,рассчитанной по уравнению Борна и измеренной экспериментально.
| Кристалл | Энергия кристаллической решетки, кДж/моль | |
| Эксперимент | Уравнение Борна | |
| NaCl | 757,8 | 749,1 |
| NaBr | 744,0 | 712,7 |
| NaI | 693,9 | 667,1 |
Энергия ионной решетки существенно больше, чем энергия межмолекулярного взаимодействия в молекулярных кристаллах, и сравнима с энергией ковалентных связей в атомном кристалле. Поэтому, как правило, разрушение ионного кристалла происходит труднее, чем молекулярного, но легче, чем атомного (механическая прочность, плавление).
Таким образом, силы взаимодействия, определяющие ионную связь, характеризуются следующими свойствами: ненасыщенностью, ненаправленностью, дальнодействием. Поэтому координационное число в ионных кристаллах определяется геометрией плотнейшей упаковки. Например, в кубической простой решетке КЧ=6, в объемоцентрированной КЧ=8, а в гранецентрированной КЧ=12.
Дата добавления: 2017-02-20; просмотров: 882;
