Области применения КМ 3 страница
При быстрой кристаллизации из расплава в большинстве кристаллизующихся полимеров возникают кристаллические образования с размерами порядка 15 – 100 нм, не имеющие строго определенной формы и без резко очерченной границы раздела кристаллического и аморфного состояний. Такие образования называют кристаллитами. При медленном охлаждении расплавов кристаллиты достигают больших размеров – образуются пластинчатые кристаллы, наиболее совершенной формой которых является монокристалл.
Кристаллические надмолекулярные структуры образуются главным образом у полимеров с пачечным строением. Глобулярные полимеры образуют единичные кристаллы только при монодисперсном строении, например, природные белки.
Итак, кристаллическая фаза полимера является сложной многостадийной формацией (пачки, ленты, пластины, фибриллы, сферолиты, единичные кристаллы), в которой имеется много дефектов (области поворота пачек, нерегулярность в укладке лент, пластин и т.д.), специфичных для полимеров. Надмолекулярные структуры полимеров представлены на рисунке 3.3.
В конденсированной фазе при кристаллизации полимеров возникают сферолиты. Сферолит – это кристаллическое образование округлой формы. Термодинамически это не самые выгодные структуры, но кинетически они предпочтительнее, поэтому являются самыми распространенными при кристаллизации в конденсированной фазе. Сферолит построен из ламелей, растущих из единого центра кристаллизации (рисунок 3.4.).
Требование дальнейшего снижения поверхностной энергии приводит к соединению лент в пластины (ламелиЛамели: кристаллиты, которые образуются в результате складывания подвижных макромолекул. Ламели отностятся к частнично кристаллизующимся видам термопластов. ) путем примыкания плоскими сторонами друг к другу (рисунок 3.4.).
Ламели, стремясь к уменьшению поверхностной энергии, наслаиваются друг на друга с образованием единичного кристалла.
В стеклообразных полимерах(при Т < Тс), когда макромолекулы в пачках малоподвижны, образуются фибриллы, в которых пачки сохраняются как отдельные элементы.
С термодинамической точки зрения главной движущей силой адсорбции полимера является взаимодействие полимерных сегментов с поверхностью, например, при адсорбции катионных полимеров на анионной поверхности. В плохом растворителе наблюдается сильное эффективное притяжение между полимером и твердой поверхностью. Полимер стремится

Рисунок 3.3. Микрофотографии надмолекулярных структур полимеров.
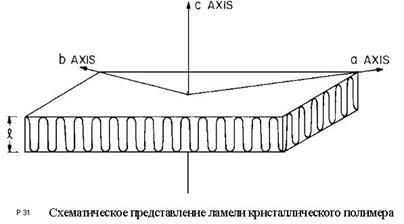
Рисунок 3.4.Схема симметричной ламели
использовать все возможности для устранения контакта с растворителем и, следовательно, адсорбируется практически на любой поверхности, даже на поверхности жидкость-воздух. Адсорбция полимера на поверхности в этом случае всегда предшествует его осаждению из раствора. Поверхности, присутствующие в системе, действуют как активные центры для осаждения полимера. Основной вывод сводится к тому, что чем хуже взаимодействие растворитель-полимер, тем выше адсорбция, и наоборот.
Адсорбция сильно зависит от природы растворителя, поскольку последний определяет форму цепи, и, таким образом, условия контакта с поверхностью при адсорбции. При образовании адгезионной связи практически всегда, даже если нанесение полимера идет через стадию раствора, эти факторы исключаются полностью. При нанесении на поверхность растворов полимеров в растворителях, слабо взаимодействующих с поверхностью, адсорбция полимеров является первичным актом образования поверхностной или клеевой пленки.
Растворители по отношению к растворенному веществу подразделяются на «хорошие» и «плохие».
Растворителем «хороший» - (ацетон) для данного полимера считается такая низкомолекулярная жидкость, в которой этот полимер образует термодинамически устойчивую систему (DG < 0) во всей области концентраций (неограниченное смешение) и в возможно большей области температур (Dj – разность между изобарно-изотермическим потенциалом раствора и компонентов).
Если низкомолекулярная жидкость с данным полимером не образует термодинамической системы ни при каких температурах и концентрациях, то он не является растворителем для данного полимера. Если полимер с низкомолекулярной жидкостью образует истинный раствор только в определенной области составов и при определенных температурах, а при изменении состава или температуры происходит расслоение системы (ограниченное смешение) – это «плохой» растворитель. Вопрос о «хорошем» и «плохом» растворителе – это вопрос об истинных и коллоидных растворах.
Критерием качества растворителя является величина термодинамического параметра c, который оценивается по изменению свободной энергии Гиббса:
D G = G р-р - S G i ni, 3.1
где G - cвободная энергия; n-мольная доля.
Чем выше по абсолютному значению Dj, тем выше качество растворителя, т.е. процесс идет самопроизвольно. В этом случае характер адсорбированных молекул будет определяться не только концентраций полимера, но и от качества растворителей.
Плохой растворитель D G → 0.
Хороший растворитель D G > 0.
В разбавленных растворах полимеров в плохих растворителях макромолекулы имеют свернутые формации (меньшие размеры) и адсорбируются в лучшей степени, чем из хороших растворителей. В концентрированных растворах помехой адсорбции является еще и взаимодействие полимер-полимер.
Адсорбция растворов существенно влияет на процессы отверждения, вулканизации, синтеза ВМС и прочностные свойства. При адсорбции полимера на поверхности снижается подвижность макромолекул, что влияет на свойства поверхностного слоя, прочность адгезионного соединения.
В зависимости от термодинамических характеристик растворителя, природы полимера, его массы (молекулярно массового распределения), температуры, давления, концентрации раствора полимеров, свободной энергии Гиббса – свойств поверхности, энергии адсорбции происходит «высаживание» молекул полимера в различном виде (рисунок 3.5.).
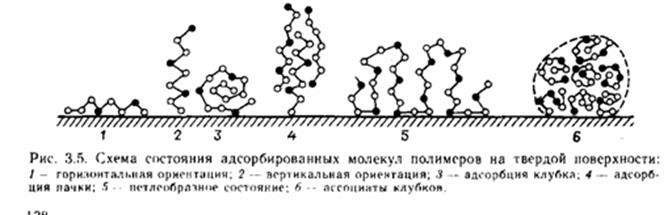
Адсорбция полимеров имеет свои специфические особенности по сравнению с адсорбцией низкомолекулярных веществ. Независимо от химического состава как аморфные, так и кристаллизующиеся олигомеры и полимеры всегда ассоциированы и образуют надмолекулярные структуры.
Термодинамически «хорошие» растворители сольватируют молекулы полимеров, способствуют развертыванию клубков и разрушению других надмолекулярных структур, высвобождая отдельные молекулы, и тем самым способствуют адсорбции их на твердой поверхности в виде толстого адсорбционного слоя. Это свойство хороших растворителей особенно проявляется при адсорбции из концентрированных растворов. В «плохом» растворителе молекулы полимеров находятся в свернутом состоянии в видеклубков и при адсорбции образуют более слабо связанный слой. Одновременно растворители сами могут адсорбироваться на активных центрах твердой поверхности, конкурируя с большими молекулами полимеров.
Характерной особенностью адсорбции полимеров является ее необратимость, за исключением случаев физической адсорбции молекул с вертикальной ориентацией. Однако это не доказательство хемосорбции. Необратимость объясняется многоточечностью закрепления при одновременном взаимодействии с твердой поверхностью многими сегментами макромолекулы. Энергия физической связи каждого адсорбционного контакта составляет 8,4—12,5 кДж/моль, и при большом числе контактов общая энергия связи макромолекул становится соизмеримой с энергией химической связи, поэтому удалить такие молекулы промывкой растворителями не всегда удается.
Полимеры, адсорбированные из плохих растворителей, адсорбируются в виде свернутых клубков — глобул и под влиянием силового поля твердой поверхности могут деглобулизироваться, развертываясь вдоль поверхности и увеличивая число связей, что сопровождается вытеснением одной макромолекулой большого числа ранее адсорбированных малых молекул в раствор.
Адсорбция полимеров на границе раздела фаз с твердым телом играет важную роль в усиливающем действии наполнителей, адгезии, склеивании и т. п. Адсорбционное взаимодействие является одним из важнейших факторов, определяющих свойства наполненных и армированных полимеров, свойства клеевых прослоек, адгезию полимеров и др. Совершенно очевидно, что многие особенности структуры адсорбционных слоев, получаемых при адсорбции полимеров на твердой поверхности из жидкой фазы, должны сохраниться и в таких системах, в которых адсорбционное взаимодействие полимера с твердой поверхностью реализуется в отсутствие растворителя, т. е. во всех практически важных системах (армированных и наполненных пластиках, покрытиях, клеях и т. п.). Для понимания свойств систем и нахождения путей их регулирования крайне важно знать структуру адсорбционных слоев в таких гетерогенных полимерных материалах.
33. Адсорбция полимеров из разбавленных растворов
В разбавленных растворах молекулы полимеров находятся в изолированном виде. Адсорбция полимеров отличается от адсорбции низкомолекулярных соединений (НМС):
- размером макромолекулы;
- ее конформацией и конфигурацией;
- наличия процессов структурирования в растворе;
- агрегирования молекул.
Адсорбция полимеров в основном зависит от концентрации полимера и качества растворителя.
Большие молекулы закрепляются лишь отдельными сегментами, содержащими функциональные группы. Участки цепи при этом направлены в раствор отдельными петлями.
С повышением концентрации полимеров в растворе в них образуются первичные, а затем вторичные надмолекулярные структуры, которые и переходят из раствора на твердую поверхность. Статистические клубки, переходя из раствора на поверхность пигментов дают «мономолекулярный» толстый слой из деформированных — сжатых клубков.
Толщина адсорбционного слоя примерно 3-5 монослоев полимера при адсорбции из плохих растворителей. Адсорбция из «плохих» растворителей больше, чем из «хороших», как правило.
3.4. Изотермы адсорбции
Экспериментальные изотермы адсорбции являются наиболее распространенным способом описания адсорбционных явлений Изотерма адсорбции (англ. adsorption isotherm) — зависимость количества адсорбированного вещества (величины адсорбции) от парциального давления этого вещества в газовой фазе (или концентрации раствора) при постоянной температуре. Изотермы адсорбции используются для расчета удельной поверхности материалов, среднего размера пор или среднего размера нанесенных частиц, распределения пор или частиц по размерам.
Методы получения адсорбционных данных для построения изотерм адсорбции основаны на измерении количества газа (жидкости), удаленного из газовой (жидкой) фазы при адсорбции, а также на различных способах определения количества адсорбата (адсорбированное вещество) на поверхности адсорбента (адсорбирующее вещество), например, волюметрический метод, гравиметрический метод и др.
Изотермы адсорбции используются для расчета удельной поверхности материалов, среднего размера пор или среднего размера нанесенных частиц, распределения пор или частиц по размерам.
Различают шесть основных типов изотерм адсорбции. Тип I характерен для микропористых твердых тел с относительно малой долей внешней поверхности. Тип II указывает на полимолекулярную адсорбцию на непористых или макропористых адсорбентах. Тип III характерен для непористых сорбентов с малой энергией взаимодействия адсорбент-адсорбат. Типы IV и V аналогичны типам II и III, но для пористых адсорбентов. Изотермы типа VI характерны для непористых адсорбентов с однородной поверхностью.
Единой теории, которая достаточно корректно описывала бы все виды адсорбции на разных поверхностях раздела фаз, не имеется; рассмотрим поэтому наиболее распространенную теорию адсорбции, описывающие отдельные виды адсорбции на поверхности раздела твердое тело – раствор.
Строгая теория изотермы адсорбции была предложена американским химиком И. Ленгмюром для монослойной модели адсорбции на однородной поверхности, в которой можно пренебречь силами притяжения между молекулами адсорбата и их подвижностью вдоль поверхности.
Уравнение изотермы Ленгмюра имеет вид:
a = ambp/(1 + bp), 3.2
где b — адсорбционный коэффициент, зависящий от энергии адсорбции и температуры; am — емкость монослоя.
Его теория мономолекулярной адсорбции основывается на следующих положениях.
1) Адсорбция является локализованной и вызывается силами, близкими к химическим.
2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента, характеризующиеся наличием свободных валентностей. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными.
3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата, в результате на поверхности может образоваться только один слой адсорбированных молекул.
4) Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется. Таким образом, через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие.
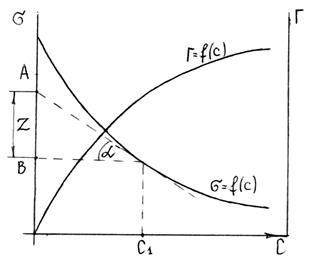
Изотерму адсорбции можно представить в обобщенном виде (рисунок 3.6.).
 Рис,
Рис,
Рисунок 3.6. Изотерма адсорбции.
С - концентрация полимера, s - доля связанных сегментов, Г- адсорбция, которая определяется по формуле:
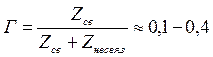 , 3.3
, 3.3
где Zcв – число связанных сегментов; Zнеcв – число несвязанных сегментов.
Доля связанных сегментов – основная характеристика процесса адсорбции.
Адсорбция Г выражается количеством адсорбтива (адсорбата) в молях, адсорбировавшегося на поверхности адсорбента, площадью 1 м2. Вблизи поверхности раздела концентрация полимера выше, чем в растворе. Толщина адсорбционного слоя и количество связанных сегментов зависят от природы полимера, его концентрации в растворе, гибкости цепей макромолекул, поверхнстной энергии. Структура адсорбционного слоя будет определяться конформацией адсорбированных макромакромолекул, их изменением в зависимости от температуры и качества растворителя.
При низкой концентрации раствора полимера адсорбированные молекулы будут крепиться к поверхности сегментами, а при увеличении концентрации молекулы связываются с поверхностью клубками.
Существует несколько методов математического выражения изотерм адсорбции, различающихся моделями, использованными для описания процесса адсорбции. При малых степенях покрытия поверхности адсорбатом для однородной поверхности уравнение изотермы адсорбции имеет вид
уравнения Генри:
a = Kp, 3.4
где a — величина адсорбции, p — давление газа, K — константа.
При средних степенях покрытия может быть применено эмпирическое
уравнение Фрейндлиха:
a = kpn, 3.5
где k и n — константы.
При малых концентрациях полимера адсорбционный слой характеризуется малой толщиной и высокой концентрацией в нем полимера. С увеличением концентрации полимера происходит перестройка структуры вновь сорбирующихся макро-молекул, нарушаются установившиеся связи. При этом общее число точек сопрокосновения с поверхностью уменьшается, а толщина адсорбционного слоя увеличивается. При адсорбции полимера происходит вытеснение молекул растворителя с поверхности твердого тела.
Для очень разбавленных растворов справедливо уравнение Ленгмюра:
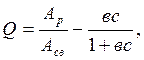 3.1 где Q – степень заполнения поверхности; Ар – количество адсорбированного полимера; с – концентрация полимера; в – const; Асв – количество адсорбированного вещества при насыщении.
3.1 где Q – степень заполнения поверхности; Ар – количество адсорбированного полимера; с – концентрация полимера; в – const; Асв – количество адсорбированного вещества при насыщении.
Для более широкого диапазона концентраций:
q = m·сa, 3.7
где m, a - const; с – концентрация. Его применимость обусловлена агрегативным механизмом адсорбции.
Адсорбционный слой можно представить в виде двух слоев:
1) более плотный вблизи поверхности, который состоит из связанных петель и адсорбированных сигментов, но менее плотный, чем монослой самого полимера;
2) менее плотный, чем первый, который состоит из простирающихся в раствор сегментов и петель, не связанных с поверхностью.
При низкой энтальпии адсорбции петли и хвосты имеют вытянутую форму, простирающиеся в раствор перпендикулярно к поверхности. При высокой энтальпии адсорбции образуются петли и хвосты малых размеров, что приводит к конформации плосколежащих на поверхности макромолекул, т.е. с увеличением энтальпии адсорбции происходит увеличение числа связанных сегментов, что приводит к сжатию адсорбционного слоя и его уплотнению.
3.5.Адсорбция полимеров из полуразбавленных и концентрированных растворов
Практический интерес представляет рассмотрение вопроса об адсорбции полимеров на твердой поверхности из полуразбавленных и концентрированных растворов, т.е. тех растворов, которые используются на практике. Эти растворы имеют собственную структуру, что будет оказывать влияние на процесс адсорбции.
При повышении концентрации статистические клубки начинают сближаться (касаться друг друга) и перекрываться (полуразбавленный раствор и концентрированный раствор). В результате этого происходит сжатие клубков и уменьшение их размеров. Переход от полуразбавленного раствора к концентрированному означает, что происходит перепутывание клубков, макромолекулы переходят к своим невозмущенным размерам, т.е.
r = z
Степень сближение гидродинамического объема макромолекулы является мерой области перехода между двумя концентрациями растворов (полуразбавленного и концентрированного). Полуразбавленные растворы – это растворы, в которых макромолекулы клубка перекрываются, но объемная доля (Ф) мала: Ф*<<Ф<<1. При концентрации, равной порогу перекрывания С=С* или в объемных долях Ф=Ф* - порог перекрывания, клубки полимера начинают касаться друг друга.
Для статистических клубков макромолекулы критическая концентрация перекрывания составляет
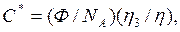 3.8
3.8
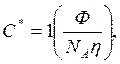 3.9
3.9
где NA – число Авогадро, h - характеристическая вязкость, связанная с радиусом вращения цепи.
Было установлено, что для каждой концентрации раствора полимера соответствуют свои размеры адсорбирующихся частиц. Адсорбция полимеров из полуразбавленных растворов происходит отдельными макромолекулами и агрегатами. Из концентрированных растворов молекулы полимера адсорбируются в виде агрегатов-ассоциатов макромолекул.
Взаимодействие клубков полимеров в растворах приводит к возникновению агрегатов макромолекул. Эти агрегаты представляют собой роевые образования взаимодействующих друг с другом клубков макромолекул с определенной продолжительностью жизни.
Термодинамической причиной образования агрегатов может быть неполная термодинамическая совместимость фракций различной молекулярной массы даже одной химической природы. Известно, что низкомолекулярные фракции легче растворяются и характеризуются меньшей способностью к суммированию сил притяжения. Такие агрегаты не являются коллоидными частицами, не имеют границы раздела с растворителями, т.е. не являются самостоятельными фазовыми частицами.
Агрегатами (ассоциатами) называют молекулярные образования-частицы, размеры которых изменяются при воздействии температуры, концентрации и других переменных (их размер 400-2000 А). Система, содержащая агрегаты является однофазной.
Образование агрегатов приводит к тому, что адсорбция макромолекул из полуразбавленных и концентрированных растворов происходит агрегатами. Это объясняется снижением их растворимости с увеличением массы полимера. В полуразбавленных растворах агрегаты образуются из небольшого количества молекул.
Адсорбированные агрегаты имеют не прочную связь с поверхностью твердого тела (адсорбентом), т.к. с ней взаимодействует только часть соприкасающихся с поверхностью молекул, входящих в агрегат. Величина адсорбции из полуразбавленных растворов на много больше, чем из разбавленных. Это связано с тем, что из разбавленных растворов макромолекулы адсорбируются в изолированном виде и крепятся к поверхности сегментами (клубки, петли), а из полуразбавленных растворов – в основном агрегатами различной величины
С увеличением роста концентрации раствора возрастает размер агрегата, что приводит к увеличению адсорбции, увеличивается концентрация полимера в адсорбционном слое.
Для концентрированных растворов важную роль играет качество растворителя. Из «плохого» растворителя полимеры легче высаживаются на поверхность адсорбата и адсорбция молекул происходит в виде агрегатов. При ухудшении качества растворителя в концентрированных растворах усиливаются межмолекулярные взаимодействия, что приводит к образованию агрегатов и изменению конформации цепи. Агрегация надмолекулярных структур полимеров обусловлена образованием водородных и химических связей. Природа полимера оказывает существенное влияние на образование агрегатов. Раствор поливинилового спирта состоит из агрегатов размером 0,005-0,2 мкм. Они являются прочными и не разрушаются даже при высоких температурах. Большинство полимеров (полистирол, полиакрилонитрил, поливинилацетат) характеризуются существованием агрегатов даже в разбавленных растворах. Размер агрегатов зависит от природы полимера, его молекулярной массы, концентрации полимера в растворе, качества растворителя. Чем выше концентрация полимера и его молекулярная масса, тем больше размер агрегата.
На величину адсорбции существенное влияние оказывает температура и чем выше концентрация раствора полимера, тем выше ее влияние. С повышением температуры возрастает броуновское (тепловое) движение макромолекул, что приводит к разрушению агрегатов в разбавленных, полуразбавленных и уменьшению размеров агрегатов в концентрированных растворах. Это способствует снижению межагрегатных взаимодействий и переходу агрегатов на поверхность адсорбента, а, следовательно, к уменьшению адсорбции. Таким образом два фактора являются определяющими адсорбцию с ростом температуры:
- снижение размеров агрегатов;
- снижение межагрегатных взаимодействий.
3.6. Молекуляро-агрегативный механизм адсорбции полимеров
Адсорбция полимеров из полуразбавленных и концентрированных растворов, в которых образуются агрегаты макромолекул, на поверхность адсорбента происходит преимущественно агрегатами. Они менее «растворимы» по сравнению с неагрегированными молекулами. Действительно, в растворе над адсорбентом после установления адсорбционного равновесия агрегаты отсутствуют (адсорбируются на поверхности). Для установления равновесия между агрегированными и неагрегированными молекулами требуется время. С течением времени в растворе устанавливается равновесная концентрация агрегатов, отвечающая данной концентрации раствора. Эти результаты подтверждают переход агрегатов на поверхность и объясняют основные особенности адсорбции из концентрированных растворов (большие величины адсорбции, наличие максимумов на изотермах адсорбции).
Уменьшение адсорбции после максимума может быть объяснено «усилением» степени структурированности раствора и возникновением в растворе сплошной пространственной сетки макромолекул, затрудняющей и далее препятствующей переходу макромолекул из объема раствора на поверхность адсорбента.
Таким механизмом можно объяснить полное прекращение адсорбции из растворов, концентрация которых превышает критическую.
С ростом концентрации раствора число молекул увеличивается в растворе быстрее, чем агрегатов и соответственно уменьшается константа агрегации. Таким образом на адсорбцию агрегатов накладывается адсорбция изолированных макромолекул, конформация которых отличается от таковой в разбавленных растворах вследствие эффекта перекрывания клубков.
Особенности адсорбции полимеров, наиболее ярко проявляющиеся при молекулярно-агрегатном механизме адсорбции, приводят к тому, что:
- при каждой концентрации раствора над адсорбентом устанавливается новое равновесие между агрегированными и свободными макромолекулами;
- каждой точке изотермы соответствует определенная структура адсорбируемых поверхностью частиц (от изолированных клубков до их агрегатов) и разное распределение тех и других на поверхности в зависимости от концентрации.
В этом случае (в отличие от НМС) форма изотермы и величина адсорбции должны зависеть от соотношения адсорбент-раствор. При таком равновесии на поверхности адсорбируются одновременно как изолированные макромолекулы, так и их агрегаты.
Если при адсорбции НМС из растворов, когда их молекулы имеют постоянную форму и состав, то при адсорбции ВМС в зависимости от концентрации раствора происходит непрерывное изменение конформаций макромолекул и степени их агрегации. Фактически при каждой концентрации раствора, т.е. для каждой точки изотермы адсорбции наблюдаются разные структуры сорбируемых частиц и различное соотношение между ними в растворе.
Структура адсорбируемых частиц полимера оказывает влияние на структуру адсорбционного слоя, на структуру адсорбционных слоев при адсорбции из растворов различной концентрации.
В случае, когда действует молекулярно-агрегативный механизм адсорбции, свойства и толщина адсорбционных слоев будут определяться структурой и размерами агрегатов. В этом случае толщина адсорбционного слоя составляет примерно 1-8 мкм. При адсорбции из разбавленных растворов эта величина адсорбционного слоя составляет примерно 0,1 мкм. При молекулярно-адсорбционном механизме адсорбции доля сегментов макромолекул, входящих в агрегат и непосредственно взаимодействующих с поверхностью адсорбента должна быть невелика и значительно меньше по сравнению с долей связанных сегментов макромолекул, адсорбированных из разбавленных растворов.
В разбавленных растворах величина доля связанных сегментов монотонно уменьшается с увеличением концентрации раствора.
При адсорбции из концентрированных растворов доля связанных сегментов с ростом концентрации уменьшается, но не монотонно, в зависимости от качества растворителя.
Переход агрегатов на поверхность способствует увеличению адсорбции, но при этом степень связывания с поверхностью значительно меньше, что приводит к образованию не прочной их связи с поверхностью. Степень связывания агрегатов молекул полимера с поверхностью зависит от:
- степени покрытия поверхности;
- структуры раствора, концентрации;
- качества растворителя.
Проведенные исследования показали, что при адсорбции ВМС из концентрированных растворов на поверхность адсорбента переходят агрегаты макромолекул с образованием толстых слоев их толщина больше, чем монослой. Изменение характера агрегирования макромолекул в зависимости от концентраций раствора полимера существенно отражается на структуре адсорбционных слоев, полученных из растворов различных концентраций полимера.
3.7. Адсорбция полимеров из растворов смесей полимеров и их расплавов
Природа и качество растворителя оказывают существенное влияние на адсорбцию полимеров. Если полимер полидисперсный: длинные и короткие макромолекулы, то адсорбируются длинные макромолекулы, а короткие остаются в растворе – это связано с растворимостью полимера в растворе, происходит фракционирование полимера по молекулярной массе и размерам.
Полимеры с большой молекулярной массой обладают более выраженной склонностью к адсорбции, чем полимеры с меньшими молекулярными массами. Отсюда вытекает много следствий. Во-первых, типичный вид изотермы адсорбции полимеров: характерно резкое увеличение адсорбции при очень низких концентрациях с последующим плато, когда адсорбция не меняется с концентрацией полимера. Очень сильная адсорбция при низких концентрациях отражает "дискомфорт" полимера в растворе из-за слабого взаимодействия полимер-растворитель. Этот эффект еще сильнее проявляется при возрастании молекулярной массы полимера. Постоянство адсорбции при более высоких концентрациях свидетельствует о насыщении поверхности полимером.
В результате фракционирования площадь поверхности обогащается высокомолекулярными фракциями полимера, а раствор - низкомолекулярными фракциями. В адсорбционном слое происходит перераспределение полимеров по массе в сторону их большего значения, т.е. структура и толщина адсорбционного слоя будет зависеть от молекулярной массы полимера, молекулярно-массового распределения его молекул и энтальпии адсорбции.
Адсорбция полимеров из их расплавов носит большое практическое и теоретическое значение. В настоящее время широкое применение находят клеи расплавы. Их можно представить как растворы высокомолекулярных соединений в низкомолекулярных фракциях. Адсорбция на твердой поверхности будет происходить сначала полимеров с низкой молекулярной массой и высокой поверхностной активностью, а затем полимеров с большей молекулярной массой и меньшей поверхностной активностью. Напротив – из растворов смесей полимеров на поверхности сначала адсорбируются полимеры с большей молеклярной массой, а затем - с меньшей.
Дата добавления: 2017-02-20; просмотров: 1289;
