Некоторые клинические аспекты
В ряде случаев может происходить нарушение трансаминирования аминокислот:
1) при гиповитаминозе В6;
2) при лечении туберкулеза антагонистами трансаминаз – фтивазидом и его аналогами;
3) при голодании, циррозе и стеатозе печени наблюдается недостаток синтеза белковой части трансаминаз.
Для диагностики имеет значение определение активности аминотрансфераз в плазме крови. При патологических состояниях происходит усиление цитолиза в том или ином органе, что сопровождается повышением активности этих ферментов в крови.
Трансаминазы находятся в различных тканях в неодинаковом количестве. АсАТ больше в кардиомиоцитах, печени, скелетных мышцах, почках, поджелудочной железе. АлАТ – в рекордном количестве в печени, в меньшей степени - в поджелудочной железе, миокарде, скелетной мускулатуре. Следовательно, повышение активности АсАТ в крови более характерно для инфаркта миокарда (ИМ), а повышение активности АлАТ может свидетельствовать о цитолизе в гепатоцитах. Так, при остром инфекционном гепатите в крови активность АлАТ > АсАТ; но при циррозе печени - АсАТ > АлАТ. Незначительное повышение активности АлАТ имеет место также при ИМ. Поэтому определение активности сразу двух трансаминаз является важным диагностическим тестом. В норме соотношение активностей АсАТ/АлАТ (коэффициент де Ритиса) составляет 1,33±0,42. При ИМ величина этого коэффициента резко возрастает, у больных инфекционным гепатитом, напротив, происходит снижение этого показателя.
Дезаминирование аминокислот.
Прямое
Для организма человека характерен процесс прямого окислительного дезаминирования, в результате которого происходит отщепление NH2 -группы с образованием NH3, НАДН·Н+ и a-кетокислоты. Дезаминирование аминокислот наиболее активно происходит в печени и почках.
Процесс катализируют ферменты оксидазы, которые являютсяфлавопротеинами. Существуют оксидазы L- и D-аминокислот. Оксидазы L–аминокислот ФМН-зависимые, а D-аминокислот – ФАД-зависимые.
Реакцию окислительного дезаминирования L-аминокислот схематически можно представить следующим образом:
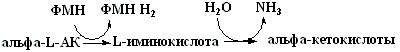
В организме человека активность оксидаз большинства аминокислот крайне низкая и наиболее активно в клетках происходит прямое окислительное дезаминирование только L–глутаминовой кислоты под действием глутаматдегидрогеназы:
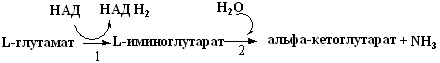
1 - глутаматдегидрогеназа (может использовать как НАД+, так и НАДФ+);
2 - стадия протекает неферментативно.
Схематически общее уравнение реакции (эта реакция обратима):
L-Глу + НАД + Н2О Û a-КГ + НАДН·Н+ + NH3
L–глутаматдегидрогеназа – фермент, катализирующий эту реакцию, имеет высокую активность и широко распространен в тканях млекопитающих.
Глутаматдегидрогеназа печени – регуляторный фермент, который локализован в митохондриях. Активность этого фермента зависит от энергетического статуса клетки. При дефиците энергии реакция происходит в направлении образования a-кетоглутарата и НАДН.Н+, которые направляются в ЦТК и окислительное фосфорилирование соответственно. В результате происходит усиление синтеза АТФ в клетке. Поэтому для глутаматдегидрогеназы ингибиторы – АТФ, ГТФ, НАДН, а активатор – АДФ.
Непрямое
Большинство аминокислот дезаминируются путем непрямого дезаминирования – это процесс сопряжения 2х реакций:
1) трансаминирование любой аминокислоты с α-кетоглутаратом с образованием глутамата;
2) глутаматдегидрогеназная реакция.
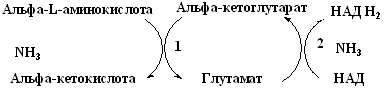
В этом случае биологический смысл трансаминирования (1) состоит в том, чтобы собрать аминогруппы всех распадающихся аминокислот в виде аминокислоты одного вида - глутамата. Далее глутаминовая кислота транспортируется в митохондрии, где подвергается окислительному дезаминированию под действием глутаматдегидрогеназы (2).
Наиболее активно непрямое дезаминирование происходит в печени. Здесь образующийся NH3 поступает в цикл мочевинообразования для обезвреживания.
Направленность равновесных процессов трансамнирования, непрямого дезаминирования во многом зависит от наличия и концентрации аминокислот и a-кетокислот. При избытке аминного азота усиливается превращение аминокислот в соответствующие кетокислоты с последую-щей их энергетической и пластической утилизацией.
Дата добавления: 2017-09-19; просмотров: 798;
