Классификация аминокислот
1). По характеру углеводородного радикала: алифатические, ароматические, гетероциклические, серосодержащие и др.:
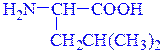
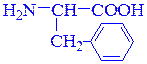
изолейцин (Ile) β-фенил-α-аланин (Phe)
α-амино-γ-метилвалериановая кислота (рац.) α-амино-β-фенилпропионовая кислота (рац.)
2-амино-4-метилпентановая кислота (IUPAC) 2-амино-3-фенилпропановая кислота(IUPAC)
(алифатическая) (ароматическая)
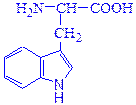
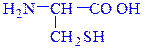
триптофан (Тrp) цистеин (Cys)
2-амино-3-(3'-индолил) пропановая 2-амино-3-меркаптопропановая
кислота (IUPAC) (гетероциклическая) кислота (IUPAC) (серосодержащая)
2). По количеству карбоксильных групп: одноосновные, двухосновные и т.д.:
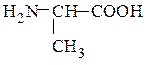
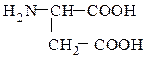
аланин аспарагиновая кислота
α-аминопропионовая кислота (рац.) α-аминоянтарная кислота (рац) аминопропановая кислота (IUPAC) 2-аминобутандиовая кислота (IUPAC)
(одноосновная) (двухосновная)
3). По количеству аминогрупп: моноамино-, диаминокарбоновые кислоты и т.д.
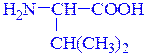
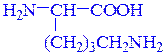
валин лизин
α-аминоизовалериановая кислота (рац.) α,ε-диаминокапроновая кислота (рац.)
2-амино-3-метилбутановая кислота (IUPAC) 2,6-диаминогексановая кислота (IUPAC)
4). По характеру углеводородного радикала: с неполярными боковыми групп-
пами (Gly, Ala, Leu, Ile, Met, Phe, Pro, Trp, Val); с полярными нейтральными
боковыми группами (Asn, Gln, Ser, Cys, Thr, Tyr); с кислотными боковыми
группами (Asp, Glu); с основными боковыми группами (Arg, His, Lys).
5). По взаимному расположению функциональных групп: α-, β-, γ-…
γ β α δ γ β α
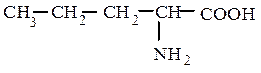
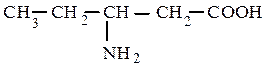
α-аминовалериановая кислота (рац.) β-аминовалериановая кислота (рац.)
2-аминопентановая кислота (IUPAC) 3-аминопентановая кислота (IUPAC)
6). По типу аминогруппы – с первичной, вторичной, третичной аминогруппой:
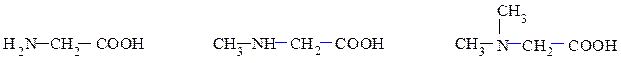
глицин N-метилглицин N,N-диметилглицин аминоуксусная кислота (рац.) N-метиламиноуксусная N,N-диметламиноуксусная аминоэтановая кислота (IUPAC) кислота кислота
Все живые организмы различаются по способности синтезировать аминокислоты,необходимые для биосинтеза белков. В организме человека часть аминокислот синтезируется (заменимые), другие должны доставляться с пищей (незаменимые). Жизнедеятельность человека обеспечивается ежеднев-ным потреблением с пищей 8 незаменимых a-аминокислот: валина, лейцина, изолейцина, лизина, метионина, фенилаланина, треонина, триптофана и двух частично заменимых (аргинина и гистидина).
Номенклатура, изомерия.Для наименования аминокислот применяются тривиальные названия и буквенные сокращенные символы. По рациональной номенклатуре аминокислоты рассматривают как производные соответствую-щих карбоновых кислот, положение аминогруппы указывается буквами a, b, g и т. По IUPAC группу NH2 называют приставкой «амино» с указанием цифрой номера углеродного атома, с которым она связана, затем следует название соответствующей кислоты. Нумерацию главной цепи осуществляют от углеродного атома карбоксильной группы. Для аминокислот характерна структурная изомерия, связанная с особенностями строения углеродного скелета и взаимным расположением групп, и пространственная (оптическая) изомерия, связанная с наличием асимметрических углеродных атомов.
Физические свойства.a-Аминокислоты – кристаллические вещества белого цвета. Они растворяются в воде с образованием электролитов, плохо – в спирте, не растворяются в эфире. Аминокислоты в твердом и растворенном состоянии имеют биполярное строение, поэтому обладают высокой т.пл.
Амфотерность –способностьa-аминокислот диссоциировать в водном растворе по типу кислоты и основания из-за наличия в их составе групп кислотного (СООН) и основного (NH2) характера. Аминокислоты существуют в виде равновесной смеси биполярного иона, катионной и анионнойформ,равновесие которых зависит от рН среды:
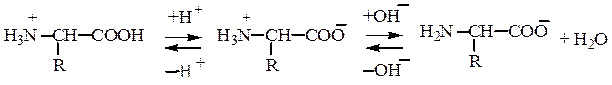 Катионная форма Биполярный ион Анионная форма
Катионная форма Биполярный ион Анионная форма
Сильнокислая среда Сильнощелочная среда
 рН 1,0 рН 7,0 рН 11,0
рН 1,0 рН 7,0 рН 11,0
Катионные формы преобладают в кислых средах, анионные - в щелочных. Значение рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм a-аминокислоты равны, называется изоэлектрической точкой(pI). В ней суммарный заряд молекулы равен нулю. Биполярные ионы не перемещаются в электрическом поле. При рН ниже рI катион a-аминокислоты (аммониевая форма) движется к катоду; при рН выше, чем pI, карбоксилат-анион аминокислоты перемещается к аноду. На этом основано разделение аминокислот методом электрофореза.
Нейтральные а-аминокислоты имеют рI несколько ниже 7,0 (5,5-6,3) из-за большей ионизации карбоксильной группы под влиянием -Iэфф +NH3 –группы:
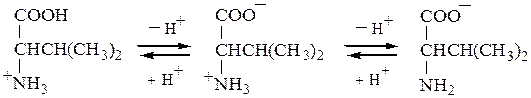
катион биполярный ион анион
Кислые а-аминокислоты,имеющие в радикале дополнительную карбоксильную группу, в сильнокислой среде находятся в полностью протонированной форме :
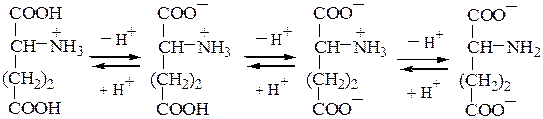
Основные а-аминокислоты имеют изоэлектрическую точку выше рН 7. В сильнокислой среде они также представляют собой трехосновные кислоты, этапы ионизации которых выглядят следующим образом:
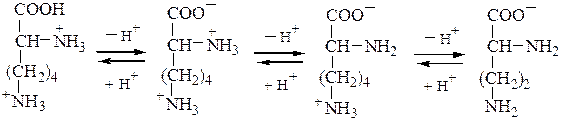
Стереохимия.Аминокислоты, кроме глицина, имеют асимметрический атом C, поэтому могут существовать в виде двух энантиомеров. Если в проекционной формуле Фишера аминогруппа, по аналогии с глицериновым альдегидом, расположена справа, то это D-изомер, если слева –L-изомер. По R,S-системе обозначений α-углеродный атом у всех α-аминокислот D-ряда имеет R-конфигурацию, у L-ряда – S-конфигурацию. У аминокислот L-ряда, если рассматривать хиральный атом со стороны атома H, группы NH3+, COO- и R расположены по часовой стрелке, у аминокислот D-ряда – против часовой стрелки.
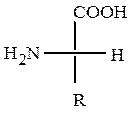
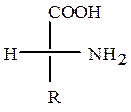
L-аминокислота (R-конфигурация) D-аминокислота (S-конфигурация)
Треонин, изолейцин, гидроксипролин содержат два асимметрических С-атома. Эти аминокислоты могут образовывать четыре диастереомера, два из которых принадлежат к L-ряду:
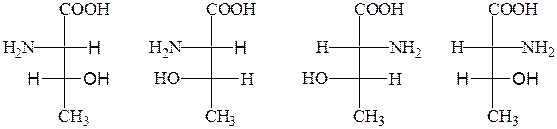
L-треонин L-алло-треонин D-треонин D-алло-треонин
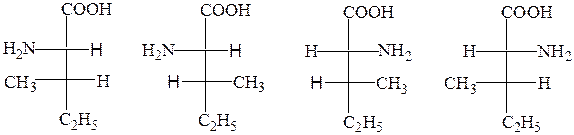
L-изолейцин L-алло-изолейцин D-изолейцин D-алло-изолейцин
Появление заместителя -ОН в пирролидиновом кольце пролина также приводит к образованию алло-форм, в которых гидроксильная и карбонильная группы находятся в цис-положении:
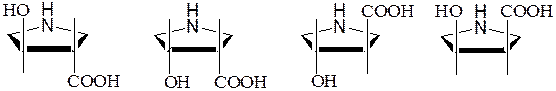
L-гидроксипролин L-алло- D-гидроксипролин D-алло-
гидроксипролин гидроксипролин
Природные α-аминокислоты принадлежат L-ряду. Аминокислоты D-ряда входят в состав некоторых биологически активных олигопептидов таких антибиотиков, как грамицидин, актиномицин. D-изомеры, как правило, не усваиваются организмом человека.
Способы получения
Природные α,L-аминокислотыполучают кислотным, щелочным или ферментативным гидролизом белоксодержащего сырьяв видесмесей, которые разделяют электрофорезом или методом ионной или другой хроматографии.
Синтетические аминокислотыполучают различными методами, приводящими обычно к выделению оптически недеятельных препаратов в виде рацемической смеси.
Способы синтеза a-аминокислот
1. Аминирование a-галогенкарбоновых кислот (по Габриэлю):
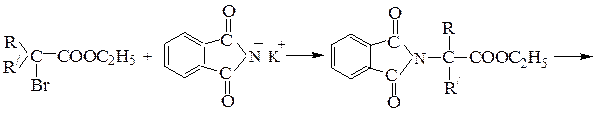
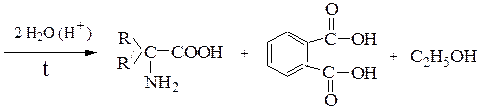
2. Из карбонильных соединений (синтез Штреккера):
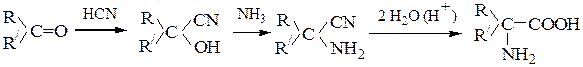
В реакцию вступают алифатические, алициклические и ароматические альдегиды и кетоны. Замещение гидроксильной группы в циангидрине под действием аммиака обеспечивается наличием по соседству сильной электроотрицательной цианогруппы. При использовании вместо аммиака первичных аминов образуются N-замещенные α-аминокислоты.
Способ является модификацией синтеза Штреккера по Тимману. В классическом методе Штреккера вначале проводят реакцию с аммиаком, а затем с HCN. Вместо HCN используют NaCN в фосфатном буферном растворе или смесь NaCN с NH4Cl (метод Зелинского-Стадникова).
3. Восстановительное аминирование a-оксокислот:
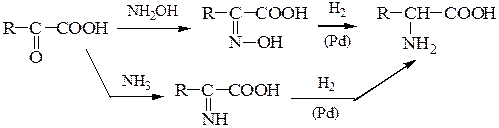
4. Синтезы a-аминокислот на основе малонового, ацетоуксусного, циануксусного и нитроуксусного эфиров
Пример 1 – Синтез лизина на основе малонового эфира:
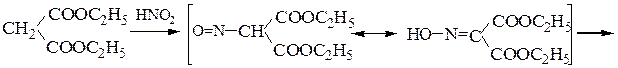
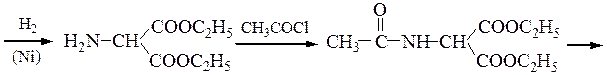
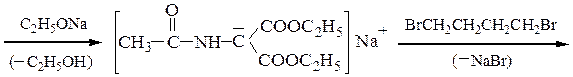
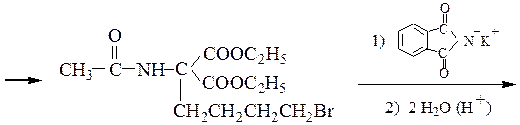
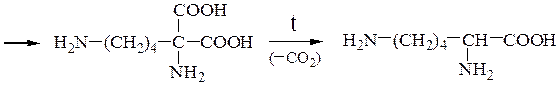
Пример 2 – Синтез лейцина на основе малонового эфира:
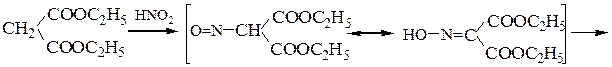
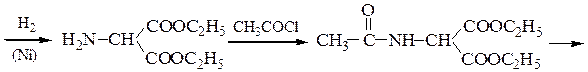
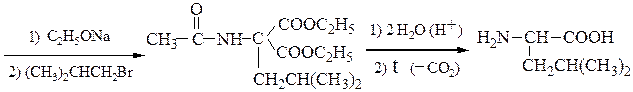
Пример 3 – Синтез аминокислот аминированием производных натрий-малонового эфира с хлорамином:
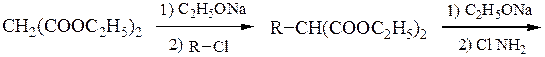
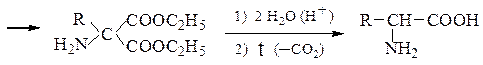
Пример 4 – Синтез аминокислот с использованием эфиров нитро- уксусной кислоты
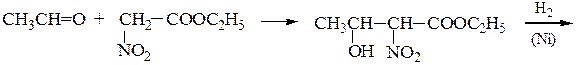
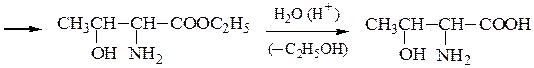
Пример 5 – Синтез a-аминокислот на основе цианоуксусного эфира с использованием метода Курциуса:
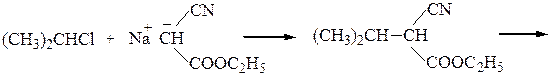
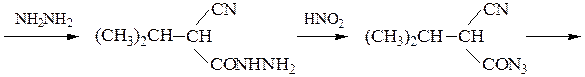
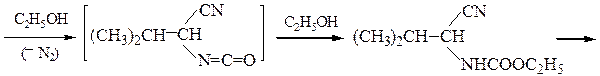
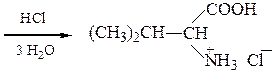 хлоргидрат валина
хлоргидрат валина
Пример 6 – Синтез a-аминокислот на основе ацетоуксусного эфира:
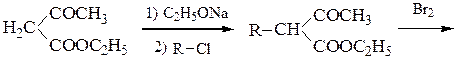
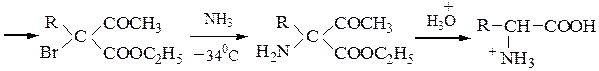
Пример 7 – Синтез a-аминокислот на основе ацетоуксусного эфира с солями диазония (метод Фиофилактова):
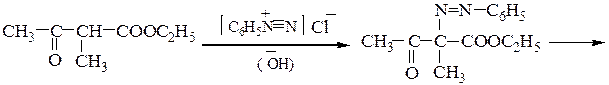
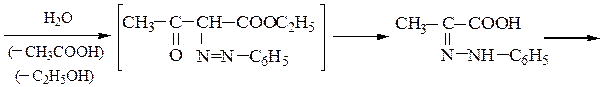
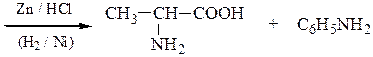
5. Синтез глутамина из глутаминовой кислоты включает получение медного комплекса по реакции с Сu(ОН)2, последующей обработкой комплекса аммиаком и его разрушения, например, действием сероводорода.
Способы синтеза b-аминокислот:
1. Аминирование b-галогензамещенных кислот:
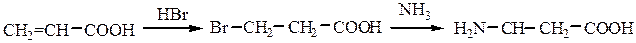
2.Восстановительное аминирование b-кетокислот:
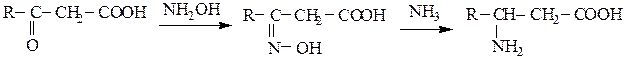
3. Аминирование α,β-непредельных карбоновых кислот:
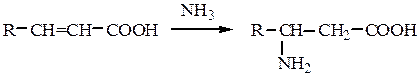
4. Синтез по Родионову:
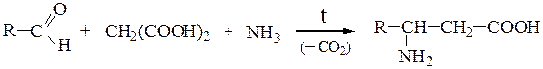
Способ синтеза ω-аминокислотзаключается в аминировании продуктов теломеризации этиленапо схеме:
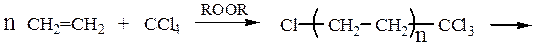
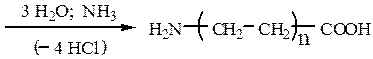
Способ синтеза ε-аминокапроновой кислотыоснованный на перегруппировке Бекмана оксима циклогексанона под действием серной кислоты, с последующим гидролизом образовавшегося ε-капролактама:
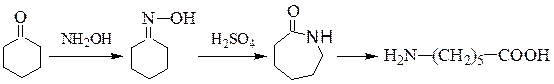
Дата добавления: 2017-09-19; просмотров: 2737;
