Химические свойства
Из-за отсутствия свободной полуацетальной гидроксигруппы, невосстанавливающие дисахариды не способны к таутомерным превращениям и мутаротации. Они не взаимодействуют с раствором Фелинга, не реагируют с раствором Толленса, не образуют гидразонов и фенилозазонов, устойчивы к действию щелочей. Так, трегалоза и сахароза в присутствии щелочей не изомеризуются и не гидролизуются, но образуют сахараты. Как и восстанавливающие дисахариды, биозы алкилируются и ацилируются по гидроксигруппам с образованием простых и сложных эфиров.
Исчерпывающее метилирование и последующий гидролиз продукта метилирования:
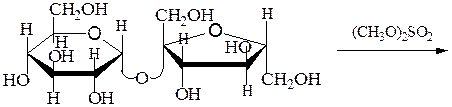
сахароза
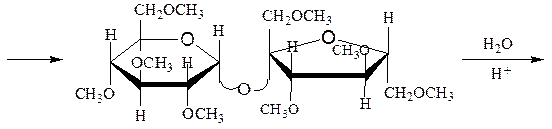
октаметилсахароза
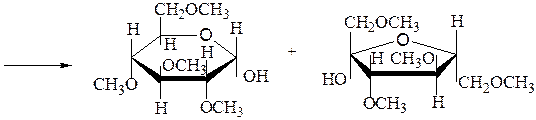
2,3,4,6-тетра-О-метил-α,D- 1,3,4,6-тетра-О-метил-a,D-
глюкопираноза фруктофураноза
Ацилирование сахарозы и гидролиз продукта реакции:
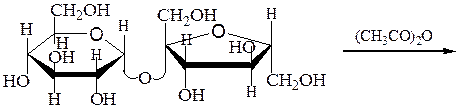
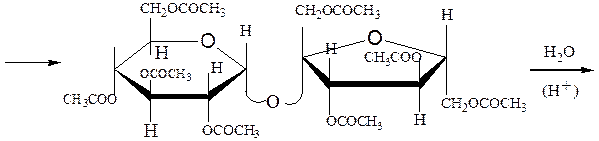
октаацетилсахароза
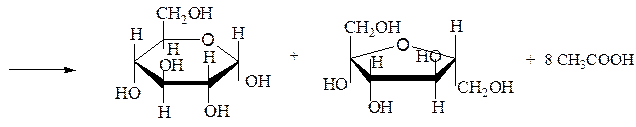
Гидролиз (инверсия) сахарозы. При кислотном или ферментативном гидролизе сахарозы образуются D-глюкоза и D-фруктоза:
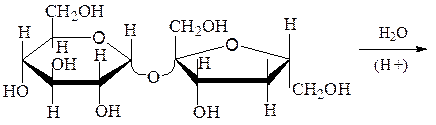
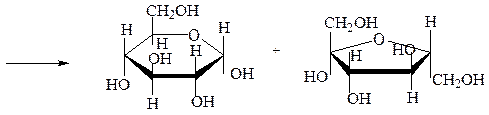
Сахароза + H2O à D-глюкоза + D-фруктоза
+ 66,5° +52,5° -92,5°
инвертный сахар
Природным инвертным сахаром, содержащим дополнительные биологические компоненты, является мед. Для ориентировочной оценки степени сладости сахаров используют данные Грютте: сахароза – 1,00; фруктоза – 1,25; глюкоза – 0,70; мальтоза – 0,60; лактоза – 0,25.
Раффиноза– α,D-галактопиранозил-[1→6]-α,D-глюкопиранозил-[1→2]-β,D-фруктофуранозид. Это невосстанавливающий трисахарид, представляющий собой бесцветное вещество, растворимое в воде и спирте. Раффиноза не восстанавливает растворы Фелинга и аммиаката серебра. Она устойчива к щелочам, гидролизуется кислотами, ферментами. Получают ее из отходов производства сахарозы, из хлопчатника и других растений. Играет в растениях роль запасного углевода. Она входит в состав невосстанавливающего тетрасахарида – стахиозы:
стахиоза

раффиноза

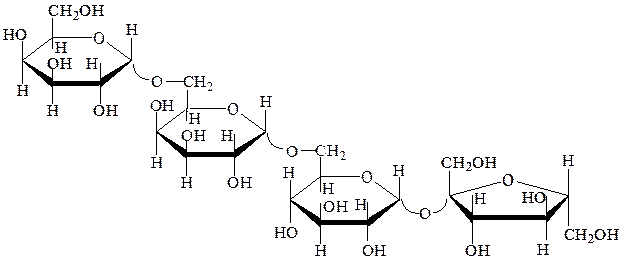
сахароза

Раффиноза и стахиоза содержатся в бобовых и масличных культурах (соя, арахис, люпин, чечевица и т.д.) в количестве до 5-8
Мелецитоза – невосстанавливающий трисахарид; компонент сладких выделений многих деревьев, в частности лип и тополей.
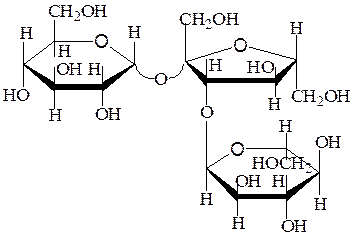
Гидролиз мелецитозы a,D-Glcр-(1®3)-b,D-Fruf-(2®1)-a,D-Glcр приводит к смеси a,D-глюкопиранозы, b,D-фруктофуранозы и b,L-галактопиранозы.
ПОЛИСАХАРИДЫ
Полисахариды – высокомолекулярные углеводы, представляющие собой продукты поликонденсации остатков моносахаридов или их производных. Моносахаридные остатки соединяются между собой гликозидными связями; по химической природе они являются полигликозидами (биополимерами). Гликозидная связь в полисахаридах так же, как и в дисахаридах, образуется при взаимодействии остатков моносахаридов в ходе реакции дегидратации. При этом каждое звено моносахарида связано гликозидными связями с предыдущим и последующим звеньями. В состав полисахаридов могут входить разные моносахариды, но наиболее часто встречаются гексозы D-глюкоза, D-манноза, D-фруктоза, D- и L-галактоза и пентозы D-ксилоза, D-арабиноза. Степень полимеризации составляет от 10 – 20 до нескольких тысяч остатков. Каждый остаток монозы в составе полисахаридов может находиться в пиранозной или фуранозной форме, иметь α- или β-конфигурацию. Для связи с последующим звеном предоставляется гликозидная гидроксигруппа, а для связи с предыдущим звеном – обычная спиртовая гидроксигруппа, чаще всего у атомов С4 или С6. В полисахаридах растительного и животного происхождения образуются 1,2- , 1,3-, 1,4- и 1,6-гликозидные связи. На конце молекулы часто находится восстанавливающий остаток моносахарида, но поскольку его доля по отношению ко всей молекуле очень мала, то полисахариды почти не проявляют восстанавливающих свойств.
Классификация. В зависимости строения полисахариды делятся на линейные и разветвленные, по составу – на гетерополисахариды, которые состоят из остатков различных моносахаридов, и гомополисахариды, состоящие из остатков одного и того же моносахарида. Гомополисахариды, включающие наиболее распространенную в природе D-глюкозу, называются глюканами. К ним относятся крахмал, целлюлоза, гликоген.
Названия гомополисахаридов слагаются из названий входящих в их состав редуцирующих моносахаридов, в которых суффикс «-оза» меняется на суффикс «-ан» (глюкан, маннан и т.д.). Разветвленный полисахарид, в основной цепи которого находятся остатки глюкозы, а в боковой остатки маннозы, называют манноглюканом, а в случае обратного распределения моноз – глюкоманнаном.
Полисахариды, составляющие в природе главную массу органического вещества, выполняют в организмах важнейшие биологические функции:
структурную в составе клеточных стенок (целлюлоза, гемицеллюлозы, пектины растений, хитин); энергетическую (крахмал, гликоген,), защитную (камеди),
Гомополисахариды
Крахмал – главный резервный полисахарид растений, продукт фотосинтеза. В растениях он содержится в виде зерен, которые имеют различную величину, форму и строение. Высоким содержанием крахмала отличаются зерновые культуры (рис – до 82 %, кукуруза – до 72 %, пшеница – до 75 %, клубни картофеля – 12-25 %). Крахмал представляет собой белый аморфный порошок, не растворимый в холодной воде, спирте; в горячей воде образует клейстер. Крахмал состоит из двух фракций амилозы и амилопектина.
Амилоза– полимер α-D-глюкопиранозы, в котором остатки глюкозы соединены α-1,4-гликозидными связями; имеет линейное строение. На долю амилозы приходится от 10-25 % крахмала. Молекулярная масса амилозы составляет ~ 400 000, в ее состав входит более 1000 моносахаридных субъединиц.
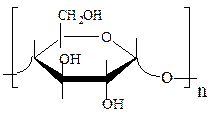
Макромолекулы амилозы способны в растворах принимать различную конформацию, чем можно объяснить многие ее свойства. В нейтральных водных растворах нормальной для амилозы конформацией является статистический клубок. Если в растворе присутствуют комплексо-образователи (например, I2), то амилоза принимает конформацию спирали, каждый виток которой содержит около шести остатков глюкозы.
Молекулы йода по своим размерам очень точно подходят к центральной полости этой спирали и образуют комплекс, обусловливающий приобретение темно-синей окраски растворами α-амилозы при йодо-крахмальном тесте. Глубина и тип окраски характерной реакции зависят от степени полимеризации и длины цепи. Эти переходы окраски отчетливо можно проследить на продуктах ступенчатого кислотного или ферментативного гидролиза крахмала при образовании декстринов различной молекулярной массы.
Амилопектин – разветвленный полимер с молекулярной массой 1-6 млн., состоит из »106 остатков D-глюкозы. Доля амилопектина в крахмале составляет 80-90 %. Остатки D-глюкозы в линейной структуре амилопектина связаны α-1,4-гликозидными связями, а боковых цепях, присоединенных к основной цепи, α-1,6-гликозидными связями:
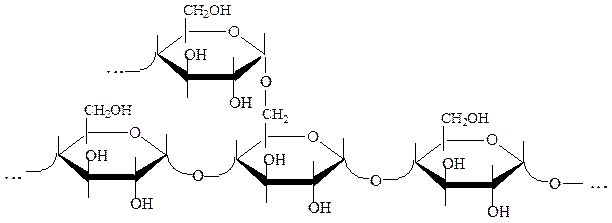
Цепи в амилопектине расположены по-разному: в виде слоистой структуры, в виде «ёлочки» и «ветвистой» структуры. Амилопектин не способен связывать йод. Это обусловлено большим числом разветвлений, что исключает возможность образования спирали.
| |
| |
Таблица 22.Зависимость степени полимеризации глюкозы и окраски йода.
| Степень полимеризации глюкозы | Окраска раствора с йодом |
| 45 и выше 35-40 20-30 30-20 20-10 10 и ниже | синяя малиновая красная оранжевая желтая нет окраски |
Образующийся красный осадок оксида меди (I) свидетельствует о появлении в гидролизате мальтозы и глюкозы.
(С6H10O5)n ¾® (С6H10O5)m ¾® C12H22O11 ¾® C6H12O6
крахмал декстрины мальтоза глюкоза
Крахмал легко усваивается в организме человека под действием фермента амилазы, являясь одним из важнейших энергетических компонентов продуктов питания (хлеб, крупа, мука, картофель и др.). Из него получают глюкозные, фруктозные сиропы, глюкозу, этиловый спирт, молочную, лимонную кислоты. В промышленности широко используют модифицированные крахмалы, которые получают обработкой или включением добавок, улучшающих их свойства. Различные виды крахмала применяются в качестве хроматографи-ческих носителей, в текстильной промышленности для изготовления красок, клеев, а также в фармацевтической и пищевой отраслях.
Гликоген – структурный и функциональный аналог растительного крахмала у животных. По строению напоминает амилопектин, но отличается большим разветвлением цепей. Как правило, между точками разветвления содержатся 10–12, а иногда и 6 глюкозных звеньев. Молекулярная масса гликогена необычайно велика, примерно 100 млн., что содействует выполнению функции резервного углевода: макромолекула гликогена из-за большого размера не проходит через мембрану клетки, оставаясь внутри, пока не возникнет потребность в энергии.
Гликоген – важнейший источник энергии для животного организма в процессе гликолиза – расщепления гликогена с образованием молочной кислоты в анаэробных условиях. Животный крахмал содержится во всех клетках организма, особенно много его в печени (10–20 %) и мышечных тканях (до 40 %). Гликоген – белый аморфный порошок, хорошо растворим в холодной воде, растворы гликогена имеют правое вращение [α]n = +196°. Онгидролизуется кислотами и ферментами, промежуточными продуктами гидролиза при этом являются декстрины и мальтоза, конечным – D-глюкоза.

амилоза амилопектин гликоген

| гликозидные остатки, соединенные α-1,4-гликозидными связями гликозидные остатки, соединенные α-1,6-гликозидными связями невосстанавливающий конец восстанавливающий конец Рис. 9. Амилоза, амилопектин и гликоген |
Целлюлоза – наиболее распространенный в природе полисахарид, так как он главный компонент клеточных стенок высших растений. Целлюлозой богаты хлопчатник (95 %), лен (до 80 %,) джут (60–70 %), древесина (40–50 %). Растения образуют в год до 1011 тонн целлюлозы.
Молекула целлюлозы линейная, она состоит из остатков β-D-глюкопираноз, соединенных 1→4-β-связями. Длина молекулы целлюлозы – до 10 тыс.остатков β,D-глюкопираноз. Молекулярная масса составляет от 250000 до 2000000 а.е.м.:
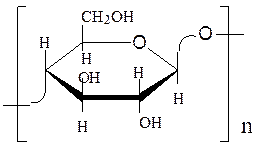
Высокоупорядоченная структура целлюлозы обусловлена способностью её индивидуальных цепей образовывать микрофибриллы за счет внутри- и межмолекулярных водородных связей. Это происходит потому, что пиранозные циклы в цепи повернуты на 180° по отношению друг к другу. В результате этого между атомами кислорода и гидроксигруппами при С-3 возникают водородные связи, делая молекулу линейной. Такие молекулы упаковываются в фибриллы (пакеты, жгуты) благодаря межмолекулярным водородным связям, что обусловливает большую механическую прочность волокон целлюлозы. Клетчатка не растворяется в воде, не образует коллоидных растворов и лишь очень небольшое число реактивов способно ее растворять (конц. H2SО4, реактив Швейцера – раствор гидрата оксида меди в аммиаке).
Химические свойства целлюлозы. Целлюлоза не окрашивается йодом, вступает в реакции по гидроксильным группам (нитрование, ацилирование), при помощи кислотного гидролиза превращается в D-глюкозу.
При обработке клетчатки концентрированными растворами щелочей образуется алкоксид целлюлозы (щелочная целлюлоза):
[С6Н7O2(ОН)3]n + n NaOH ¾® [C6H7О2(OH)2ONa]n + n Н2О
Данный процесс, называемый мерсеризацией, применяется для придания хлопчатобумажным тканям лучшей окрашиваемости и более красивого внешнего вида. Щелочная целлюлоза, кроме того, используется в производстве вискозного волокна и эфиров целлюлозы.
Общим способом получения простых эфиров является взаимодействие щелочной целлюлозы с галогеналкилами или алкилсульфатами:
[C6H7O2(OH)2ONa]n + 3n C6H5CH2Cl + 2n NaOH ¾®
¾® [С2Н7О2(OСН2C6Н5)з]п + 3n NaCI + 3n Н2.О
[C6H7O2(OH)2ONa]n + 3n (CH3О)2SO4 + 2n NaOH ¾®
¾® [C6H7O2(OCH3)3]n + 3n CH3NaSО4 + 2n H2О
Среди простых эфиров целлюлозы большое значение имеют метил-, этил- и бензилцеллюлоза. Метилцеллюлоза применяется в текстильной, косметической и пищевой промышленности. Этилцеллюлоза используется в производстве пластмасс, пленок, лаков.
| |
При взаимодействии целлюлозы с уксусным ангидридом образуется ацетилцеллюлоза. Она растворяется в органических растворителях, ее используют для получения ацетатного шелка и негорючих кино- и фотопленок.
Целлюлоза хорошо растворяется в щелочи в присутствии сероуглерода с образованием ксантогенатов. При подкислении из полученного раствора (вискоза) вновь выделяется целлюлоза. Если вискозу продавливать через тонкие отверстия (фильеры) в водный раствор серной кислоты, получают тонкие нити, из которых получают искусственное волокно – вискозный шёлк. Продавливание вискозы через тонкие щели приводит к получению прозрачной плёнки целлофана.
Схема 23. Химические реакции целлюлозы.
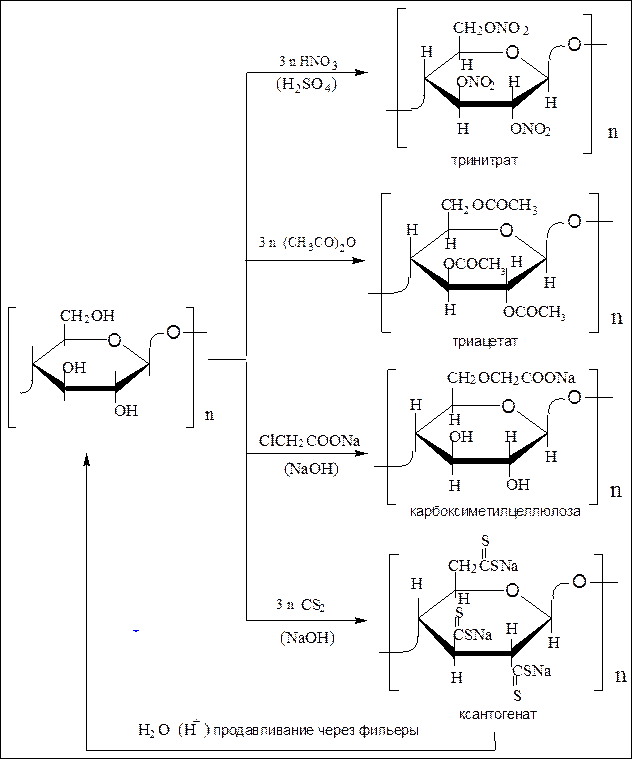
Гидролиз целлюлозы серной кислотой под давлением обеспечивает получение глюкозы:
(С6H10O5)n ¾® (С6H10O5)m ¾® C12H22O11 ¾® C6H12O6
целлюлоза целлодекстрины целлобиоза глюкоза
Глюкоза может быть сброжена с образованием этилового спирта:
С6Н12О6 ¾® 2 С2Н5ОН + 2 СО2
Спирт, полученный таким образом, называется гидролизным. Он содержит примеси метанола, и поэтому применяется только для технических целей.
Целлюлоза не усваивается организмом человека, т.к. у него отсутствует фермент, расщепляющий гликозидные связи между остатками β-глюкозы. Многие животные, особенно жвачные, успешно ее усваивают. В организме человека целлюлоза входит в состав пищевых волокон, выполняющих роль детоксикантов тяжелых металлов, радионуклидов, канцерогенных и токсичных продуктов обмена различных видов соединений.
Основные химические превращения целлюлозы изображены на схеме 23 (см. с. 281):
Хитин –гомополисахарид, построенный из остатков N-ацетил-2-глюко-замина, соединенных между собой β-1,4-гликозидными связями. Хитин входит в состав клеточных стенок грибов, а также служит основным структурным полисахаридом покровов тела насекомых и панциря ракообразных.
Фруктаны – полисахариды, построенные из остатков D-фруктозы; найдены в некоторых растениях, зеленых водорослях и бактериях.
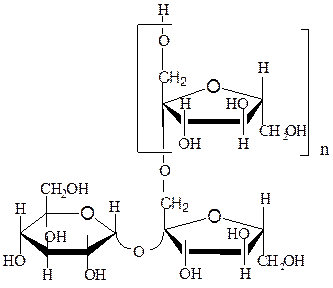
инулин; при n = 1 изокестоза (1-кестоза)
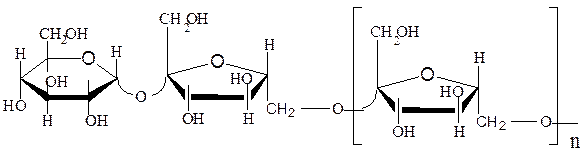
флеин (при n = 1 6-кестоза)
Фруктаны являются продуктами фруктозилирования сахарозы, поэтому каждая их молекула содержит один остаток D-глюкозы и лишена восстановительных свойств. В образовании гликозидных связей фруктанов участвуют только первичные гидроксильные группы, все остатки фруктозы имеют фуранозную форму и β-конфигурацию гликозидного гидроксила. Поскольку молекула сахарозы содержит три первичных гидроксила, возможны три различных трисахарида (1-кестоза, 6-кестоза и неокестоза, у которой фруктофураноза присоединена по первичному гидроксилу глюкозы).
Последовательное присоединение остатков β,D-фруктофуранозы к 1-кестозе связями β-(2→1) образует инулин, а к фруктозному остатку 6-кестозы связями β-(2→6) – флеин. Макромолекулы инулина преимущественно линейны, молекулярная масса их не превышает 6000 и представляет собой цепь из 35 – 40 фруктозных остатков.
В клетках растений фруктаны выполняют роль резервного запасного материала, осморегулятора и антифриза. Инулин содержится в клубнях топинамбура, цикория, одуванчика и георгинов, откуда может быть получен экстракцией горячей водой. Инулин используется как заменитель крахмала в питании диабетиков, а сырье, богатое инулином, – для производства D-фруктозы.
Другим типом фруктанов является леван, у которого остатки фруктозы соединены β-2,6-гликозидными связями. Леван, как и инулин, также содержит α-D-глюкопиранозный остаток:
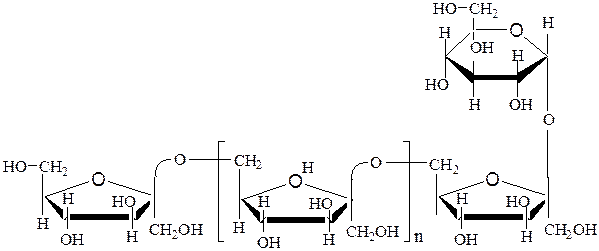
Фруктаны не являюся восстанавливающими сахаридами, поскольку аномерные углеродные атомы концевых моносахаридных остатков участвуют в образовании гликозидной связи.
ГЕТЕРОПОЛИСАХАРИДЫ
Полисахариды, в состав которых входят остатки различных моноз. В молекулах гетерополисахаридов обнаружены D-ксилоза, D- и L-арабиноза, D-манноза, D-галактоза, L-фукоза (6-дезоксигалактоза), L-рамноза (6-дезоксиманноза) и др. моносахариды.
Макромолекулы гетерополисахаридов могут иметь линейную или разветвленную структуру. К гетерополисахаридам относятся пектиновые вещества, агароза, альгиновые кислоты, слизи, камеди, гемицеллюлозы, каррагинаны и т.д. Ниже приведены примеры некоторых гетерополисахаридов:
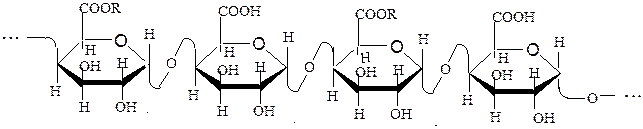 R = H (пектиновая кислота), CH3(пектин)
R = H (пектиновая кислота), CH3(пектин)
|
b-1,3-связь b-1,4-связь 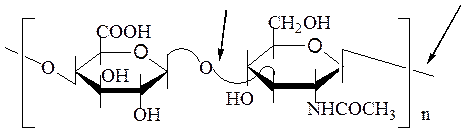
гиалуровая кислота
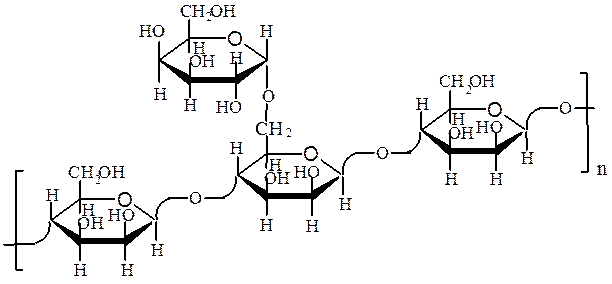
галактоманнан
Гепарин –гетерополисахарид, являющийся природным антикоагулянтом; препятствует свертыванию крови. Полисахарид содержит два повторяющихся дисахаридных звена, связанных a-1,4-гликозидной связью. Первое звено включает О-сульфированную во втором положении L-идуроновую кислоту и 2-дезокси-2-сульфамидо-D-глюкозо-6-сульфат (I), второе построено из остатков D-глюкуроновой кислоты и 2-дезокси-2-сульфамидо-D-глюкозо-6-сульфата (II).
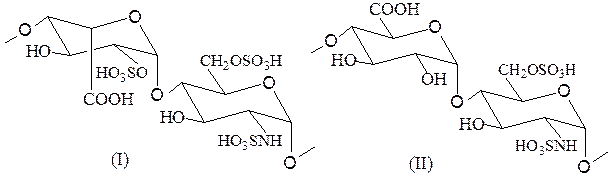
Агарполучаемый из морских красных водорослей, находит применение в производстве желе, мармелада, студней, мороженого. Содержит агаропектин и до 80% агарозы – линейного полисахарида, построенного из чередующихся остатков 3-О-замещенной β,D-галактопиранозы и 4-О-замещенной 3,6-ангидро-α,L-галактопиранозы.
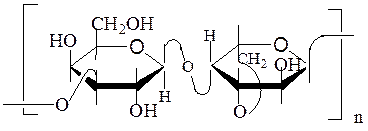
3-О-замещенная- 4-О-замещенная -3,6-ангидро-
β,D-галактопираноза α,D-галактопираноза
Контрольные вопросы к главе 17 «Углеводы».
№ 1.Сколько центров асимметрии содержат альдотетрозы и кетопентозы? Изобразите структурные формулы всех стереоизомеров для этих соединений.
№ 2.Напишите таутомерные формы для сахаридов: (а) L-фруктозы; (б) D-маннозы; (в)мальтозы; (г)D-арабинозы; (д)2-дезокси-D-галактозы.
№ 3.Составьте схему превращения низших альдоз в высшие (синтез Фишера-Киллиани) на примере получения D-глюкозы и D-маннозы из D-арабинозы. Рассмотрите методы укорочения углеродной цепи в молекуле альдоз (схемы Воля, Руффа, Вермана) на примере превращения D-глюкозы или D-маннозы в D-арабинозу.
№ 4. Выберите из перечисленных соединений те, что дают положительную пробу с реактивами Фелинга и Толленса: D-рибоза; метил-b,D-рибофуранозид; L-галактоза; октаметилмальтоза; метил-a,D-глюкопиранозид; сахароза; метил-b,D-глюкопиранозид. Приведите структурные формулы веществ, а для тех случаев, где возможно протекание химических превращений, напишите уравнения реакций.
№ 5.Напишите уравнения реакций: D-глюкозы этанолом (в присутсчтвии хлороводорода), D-галактозы с алюмогидридом лития, L-ксилозы с уксусным ангидридом, эпимеризации D-арабинозы, гидролиза октаметил-сахарозы; целлобиозы с аммиакатом серебра
№ 6. Сколько существует восстанавливающих дисахаридов, составленных из остатков D-глюкозы и D-фруктозы ?
№ 7.Сукралоза (трихлоргалактосахароза) (Е 955) - 1,6-дихлор-β,D-фрукто-фуранозил-4-дезокси-4-хлор-α,D-галактопиранозид – интенсивный подсласти-тель пищевых продуктов нового поколения; сладость сукралозы в 600 раз выше сахарозы. Изобразите структурную формулу этого вещества. Сколько таутомерных форм имеет сукралоза? Какие химические реакции она дает
№ 8. С помощью каких химических тестов можно различить следующие углеводы: (а)D-глюкозу и D-сорбит; (б) D-глюкозу и D-фруктозу; (в) сахарозу и мальтозу; (г)метил-b,D-глюкопиранозид и 2,3,4,6-тетра-О-метил-b,D-глюко-пиранозу; (д)глюкозу и крахмал; (е) D-арабинозу и D-глюкозу.
№ 9. D-Арабиноза и D-рибоза дают один и тот же озазон. D-рибоза восстанавливается до оптически неактивного пятиатомного спирта. При деструкции по Волю D-арабиноза образует тетрозу D-эритрозу, которая в результате окисления конц. HNO3 превращается в мезовинную кислоту. Каковы конфигурации D-арабинозы, D-рибозы и D-эритрозы ?
№ 10. Установите структуру дисахарида мелибиозы, имея в распоряжении следующие данные:1) мелибиоза – восстанавливающий сахар, подвергается мутаротации и образует фенилгидразон; 2) гидролиз мелибиозы в кислоте или с a-галактозидазой приводит к смеси D-галактозы и D-глюкозы;3) окисление бромной водой дает мелибионовую кислоту, а ее дальнейший гидролиз – к D-галактозу и D-глюконовую кислоту. Метилирование мелибионовой кислоты с последующим гидролизом дает 2,3,4,6-тетра-О-метил-D-галактозу и 2,3,4,5-тетра-О-метилглюконовую кислоту. Напишите уравнения реакций.
АМИНОКИСЛОТЫ
Определение.Полифункциональные соединения, содержащие амино (-NH2) и карбоксильные (–СООН) группы, способные реагировать друг с другом с образованием пептидной связи. 22 α,L-аминокислоты входят в состав белков.
Дата добавления: 2017-09-19; просмотров: 10552;
