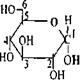
Эфиры серной кислоты
1. Хлорангидриды сульфокислот или сульфохлориды могут быть получены из сульфокислот действием пентахлорида фосфора:
CH3SO3H + PCl5 → CH3SO2Cl + POCl3 + HCl
метансульфохлорид
Однако обычно используют методы прямого сульфохлорирования углеводородов, различные для алифатических и ароматических соединений:
CH3CH2CH2CH3 + SO2 + Cl2 → CH3CH2CH – SO2Cl + HCl
│
CH3
бутан-2-сульфохлорид
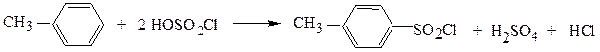
п-толуолсульфохлорид
Свойства сульфохлоридов подобны свойствам хлорангидридов карбоновых кислот. При взаимодействии со спиртами образуются эфиры сульфокислот, при реакции с аммиаком – амиды:
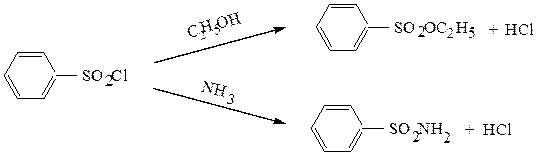
2. Эфиры сульфокислот – жидкости или твердые вещества. Они являются хорошими алкилирующими средствами:

метилфенилсульфид
3. Амиды сульфокислот – кристаллические вещества, способные
растворяться в щелочах:
RSO2NH2 + NaOH → RSO2NHNa + H2O
Гипохлорит натрия замещает водород при азоте на атом хлора:
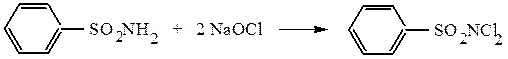
Бензолдихлорсульфамид (хлорамин Б) и подобное производное толуола (хлорамин Т) используются как мягкие дезинфектанты в медицине и пищевой промышленности.
Простейшим лекарственным веществом большой группы сульфамидных препаратов является белый стрептоцид – п-амино-бензолсульфамид:
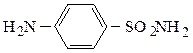
Отщепление воды от о-карбоксибензолсульфамида приводит к образованию имида, натриевое производное которого в 500 раз слаще сахара, не усваивается организмом и, практически, безвредно. Известно под названием сахарин.
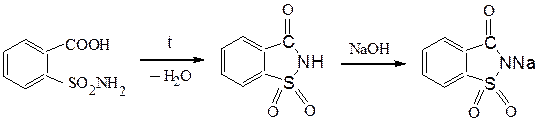
сахарин
4 При восстановлении сульфокислот образуются меркаптаны:
RSO3H + Zn + H2SO4 → RSH
5. При кипячении сульфокислот с водой отщепляется серная кислота. Эта реакция обратная сульфированию:
R – SO3H + H2O → R – H + H2SO4
6. Реакции ароматических сульфокислот по бензольному ядру.
Cульфогруппа как типичный заместитель-акцептор – ориентант II рода – дезактивирует ядро и направляет вновь вступающий заместитель в мета-положение.
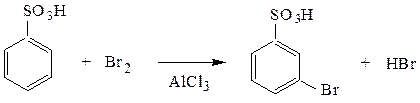
м-бромбензолсульфокислота
Легко образуются при реакции серной кислоты с алкенами и спиртами:
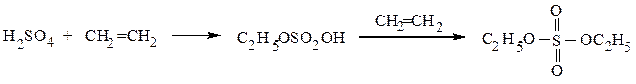
этилсерная кислота диэтилсульфат
С12H25OH + H2SO4 → C12H25OSO3H
монолаурилсульфат
При кипячении в воде моно- и диэфиры гидролизуются. Так получают сернокислотным методом синтетические этиловый и изопропиловый спирты:
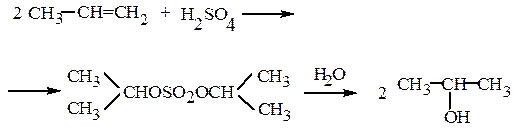
Моноэфиры серной кислоты являются сильными кислотами. С металлами, их оксидами и гидроксидами образуют соли. Лаурилсульфат натрия – эталонное анионное ПАВ. Хорошими поверхностно-активными веществами являются и сульфоэтоксилаты – продукты реакции серного ангидрида с синтанолами:
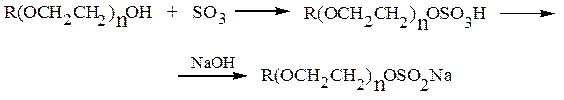
Эфиры серной кислоты – хорошие алкилирующие средства:
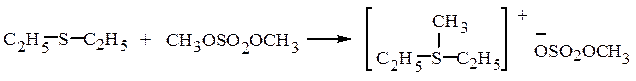
метилдиэтилсульфоний метилсульфат
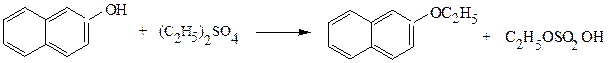
этиловый эфир β-нафтола
Контрольные волросы к главе 16 «Органические соединения серы»
№ 1. Какие классы сероорганических веществ Вам известны? Каковы пути синтеза и основные химические свойства этих соединений?
№ 2. К какому типу реакций относится сульфохлорирование алканов? Рассмотрите механизм реакции сульфохлорирования пропана.
№ 3. Сопоставьте механизм сульфирования бензола олеумом с другими реакциями электрофильного замещения в ядре бензола, например галогенирования. Расположите соединения в порядке уменьшения скорости сульфирования: изопропилбензол, анизол (метилфениловый эфир), бензол, нитробензол, м-динитробензол. Предскажите продукты сульфирования следующих веществ: (а) бромбензола; (б) п-нитротолуола; (в) м-дихлорбензола; (г) о-толуиловой кислоты; (д) о-оксибензойной кислоты (салициловой кислоты)
№ 4. Какое значение имеет обратимость реакции сульфирования для синтеза α- и β-нафталинсульфокислот?
№ 5. При сульфировании толуола при комнатной температуре образуется 75 % пара-, 20 % орто- и 5 % мета-толуолсульфокислот. Рассчитайте, сколько получится каждого из изомеров (в г), если в реакцию введено 0,5 моль толуола. Какое влияние оказывает метильная группа на скорость сульфирования (по сравнением с бензолом)?
№ 6. Какие вещества получаются при действии на п-толуолсульфокислоту cледующих реагентов: (а) перегретого водяного пара; (б) водного раствора гидроксида калия; (в) этанола; (г) этиламина; (е) при сплавлении с гидроксидом натрия; (ж) при сплавлении с цианистым натрием; (з) пентахлорида фосфора.
№ 7. Напишите уравнения реакций и назовите образующиеся соединения: (а) диметилсульфата с 2-нафтолом; (б) метилэтилсульфида с бромистым изобутилом; (в) бензолсульфокислоты с пентахлоридом фосфора, затем с п-толуидином; (г) бензилмеркаптана с хлорангидридом пропионовой кислоты; (д) этандитиола-1,2 с уксусным альдегидом.
№ 8. Хлорамин-Т и дихлорамин-Т (эффективные антисептические средства) получают из толуола по следующей схеме:
ClSO2OH NH3 NaClO
толуол ¾¾¾¾® п-толуолсульфохлорид ¾¾® А ¾¾¾¾®
(1 моль)
NaClO (избыток)
¾¾® хлорамин Т ¾¾¾¾¾¾® дихлорамин-Т
Составьте уравнения реакций и приведите структурные формулы
хлорамина-Т и дихлорамина-Т.
№ 9. Установите строение соединений, если известна молекулярная формула веществ и продукты их превращений: (а)С8Н10О3S; при щелочном гидролизе образуется соль С7Н7О3SNa, которая при сплавлении с NaOH дает п-крезол; (б)С8Н10О3S; при окислении K2Cr2O7 образуетсульфобензойную кислоту, а при щелочном плавлении п-этилфенол;(в)С7H8O3S; при окислении перманганатом калия превращается в сульфобензойную кислоту, а при сплавлении с NaOH __ в о-крезол; (г)С6H6O4S; с FeCl3 дает фиолетовую окраску; при сплавлении с NaOH (и последующим подкислении) превращается в С6Н6О2, при окислении которого образуется бензохинон (циклогексадиен-2,5-дион-1,4) (д) 1-бромпропан реагирует с избытком гидросульфида калия с образованием С3Н8S (А). Соединение (А) окисляется конц.HNO3 до вещества С3Н8О3S (Б). Соединение (Б) реагирует c РСl5, давая хлорангидрид (В).
№ 10. Осуществите указанные ниже последовательные реакции и назовите все образующиеся соединения:
Н2SО4 Br2 K2S [ O ]
(а) толуол ――→ А ―――→ Б ――→ В ―――→ Г
свет
HCl ? 2 [ O ]
(б) пропилен ――→ А ―→ [(CH3)2CH]2S ――――→ Б
( H2O2 )
H2S KOH C2H5Br 2 [ O ]
(в) пропанол-2 ――――→ А ――→ Б ―――→ В ――――→ Г
t ; Al2O3 ( H2O2 )
3 [ O ] PСl5 этилат натрия
(г) бутантиол-2 ―――→ А ―――→ Б ――――――→ В
NaCN ? 2 HOSO2Cl
(д)бензолсульфокислый ―――→ А ―→ бензойная ――――→ Б
натрий t кислота
УГЛЕВОДЫ
Углеводы – группа природных веществ, составляющих основную массу органических соединений на Земле. Углеводы в живых организмах выполняют различные функции: служат источником энергии, являются «строительным материалом» клеточных стенок растений, микроорганизмов, соединениями с защитными (иммунными) свойствами млекопитающих. Они входят в состав нуклеотидов, из которых построены нуклеиновые кислоты, осуществляющие биосинтез белка и передачу наследственных свойств, являются составной частью сложных белков. Их используют для производства искусственных волокон, бумаги, спиртов, лекарственных препаратов, взрывчатых веществ. Углеводы – один из основных компонентов пищевых продуктов. В растениях углеводы образуются в процессе фотосинтеза из диоксида углерода и воды, а в реакциях метаболизма они являются источниками энергии:
Таблица 21. Фотосинтез и метаболизм углеводов.
| Фотосинтез | хлорофилл x СO2 + y H2O + солнечная энергия ¾¾¾® Cx (H2O) y + x O2 |
| Метаболизм | C x (H2O) y + x O2 ¾® x СO2 + y H2O + энергия |
Животные организмы не способны синтезировать углеводы и получают их из растительных источников. Таким образом, углеводы, будучи первичными продуктами фотосинтеза, служат своеобразным мостиком между минеральными и органическими соединениями, между растительным и животным миром.
Классификация. Углеводы подразделяют на три группы: моносахариды (монозы, простые сахара), олигосахариды и полисахариды (сложные сахара). Моносахариды не подвергаются гидролизу и состоят из одной полигидрокси-альдегидной или полигидроксикетонной структуры. Олигосахариды содержат от 2–10 остатков моносахаридов, соединенных гликозидной связью и полисаха-риды (биополимеры на основе моносахаридов) гидролизуются до моносахаридов.
МОНОСАХАРИДЫ
Наиболее распространенные моносахариды – полиоксиальдегиды и полиоксикетоны имеют неразветвленную цепь углеродных атомов и одну карбонильную группу; число гидроксильных групп при этом равно (n – 1), где n – общее число атомов углерода. Встречаются моносахариды, у которых число гидроксильных групп меньше (n–1), тогда они называются дезоксисахаридами. В зависимости от длины углеродной цепи (3–10 атомов) моносахариды делятся на триозы (3), тетрозы (4), пентозы (5), гексозы (6) и т.д. В природе наиболее распространены пентозы и гексозы.
Структура и стереоизомерия.Моносахариды существуют в открытой форме (оксоформа) и циклических формах, которые в растворах находятся в динамическом равновесии (кольчато-цепная таутомерия).
Открытые формы. В молекулах моносахаридов одновременно содержатся карбонильная (альдегидная или кетонная) группа и несколько гидроксильных групп.Моносахариды, содержащие альдегидную группу, называются альдозами (полиоксиальдегиды), кетонную группу (обычно в положении 2) – кетозами (полиоксикетоны). Строение альдоз и кетоз можно представить в общем виде:
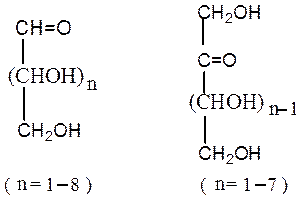
Открытые формы моносахаридов изображают в виде проекционных формул Фишера. Углеродную цепь в них располагают вертикально. У альдоз наверху записывают альдегидную группу, у кетоз – первичную спиртовую группу, соседнюю с карбонильной группой. Нумерация цепи начинается с этих групп:
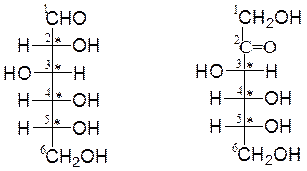
D-глюкоза D-фруктоза
Молекулы моносахаридов содержат несколько центров хиральности (*) (асимметрических атомов углерода), что служит причиной существования большого числа стереоизомеров – 2n (где n – количество хиральных центров). О принадлежности моносахаридов к D- или L-ряду судят при сравнении с глицериновым альдегидом. Это вещество содержит один асимметрический углеродный атом и существует в виде двух стереоизомеров, которым соответствуют следующие проекционные формулы Фишера:
зеркало

D-(+)-глицериновый альдегид L-(-)-глицериновый альдегид
R-глицериновый альдегид S-глицериновый альдегид
Глицериновый альдегид служит конфигурационным стандартом, по которому определяется относительная конфигурация (D- или L-) моносахаридов. С конфигурацией хирального центра глицеринового альдегида сравнивается конфигурация наиболее удаленного от карбонильной группы (предпоследнего в цепи) асимметрического атома углерода. Можно также считать, что к D-ряду относятся альдозы, которые получаются из D-глицеринового альдегида путем последовательного удлинения цепи со стороны альдегидной группы (см. ниже генетический ряд природных D-альдоз).
Видно, что 8 стереоизомеров D-альдогексоз с одинаковой формулой С6Н12О6 имеют одинаковое химическое строение, но отличную конфигурацию групп у одного или нескольких асимметрических атомов углерода, т.е. они являются диастереомерами. Диастереомеры, которые отличаются друг от друга конфигурацией атомов у одного асимметрического атома углерода, называются эпимерами. Каждой альдозе (кетозе) D-ряда соответствует энантиомер L-ряда с противоположной конфигурацией всех центров хиральности. Энантиомеры являются несовместимыми зеркальными изображениями (стереоизомеры) с одинаковыми абсолютными величинами углов оптического вращения, но противоположными по знаку, отсюда их называют еще оптическими изомерами.
Предшественником кетоз считают 1,3-дигидроксиацетон (1,3-дигидрокси-пропанон-2) (см. с. 248).
зеркало
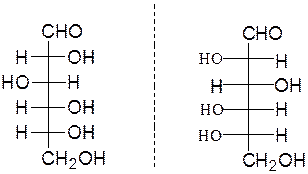
D-глюкоза L-глюкоза
Схема 22.Генетический ряд природных D-альдоз
D-глицериновый альдегид
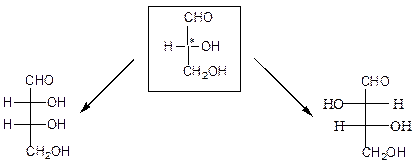
D-эритроза D-треоза
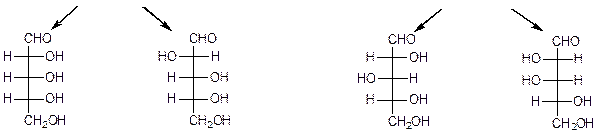
D-рибозаD-арабинозаD-ксилоза D-ликсоза
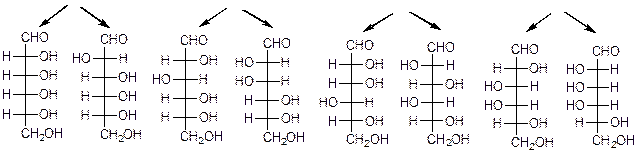 D-аллоза D-альтроза D-глюкозаD-манноза D-гулоза D-идоза D-галактоза D-таллоза
D-аллоза D-альтроза D-глюкозаD-манноза D-гулоза D-идоза D-галактоза D-таллоза
Циклические формы. Образуются в результате внутримолекулярного взаимодействия альдегидной группы монозы с гидроксильной группой при пятом или шестом атоме углеродного скелета. Полуацетальный гидроксил, образовавшийся при циклизации, называется гликозидным. По своим свойствам он значительно отличается от остальных групп ОН сахаров, обладающих свойствами обычных спиртов. Пятичленные циклические формы моноз называются фуранозами, шестичленные – пиранозами. В отличие от них, оксоформы моноз получают соответствующие приставки «аль» или «кето»: аль-D-глюкоза, кето-D-фруктоза.
Для циклических форм моносахаридов приняты перспективные формулы Хеуорса, в которых циклы располагают в виде плоских пяти- или шестичленных правильных многоугольников, лежащих перпендикулярно
Схема 23. Генетический ряд D-кетоз
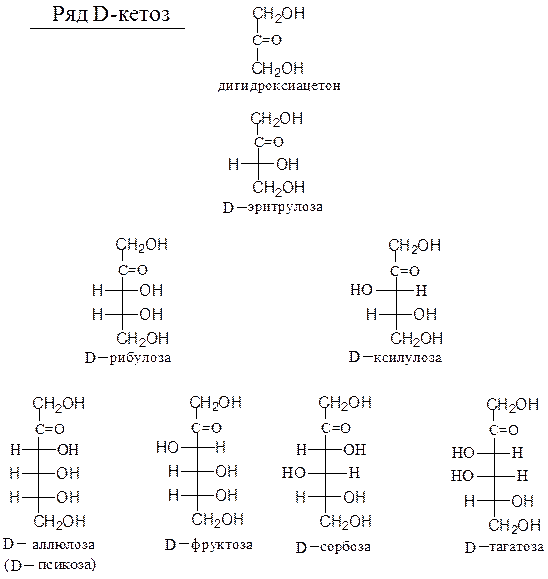
плоскости рисунка. Атом кислорода в цикле в шестичленном цикле помещают в дальнем правом углу, в пятичленном цикле – в верхнем углу. Символы атомов углерода не обозначаются. Нумерация в цикле начинается с углеродного атома, при котором находится гликозидный гидроксил.

пиранозный цикл фуранозный цикл
Заместители, находящиеся в проекционной формуле Фишера, слева – располагают над плоскостью цикла, справа – под плоскостью цикла.
Построение циклических форм D-рибозы:
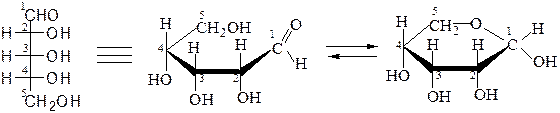
аль-рибоза D-рибопираноза (1,5-рибоза)
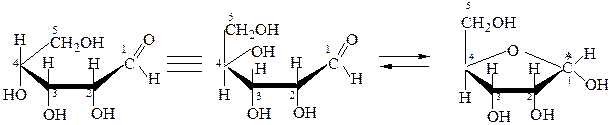
аль-рибоза D-рибофураноза (1,4-рибоза)
При этом гидроксильные группы, расположенные в проекционной формуле Фишера справа от асимметрического С-атома,оказываются под плоскостью кольца, а СH2OH – сверху. При таком строении и сохранении нумерации аль-формы атомы углерода в цикле при взгляде на проекционную формулу сверху располагаются по часовой стрелке. При первом атоме углерода появляется гликозидный гидроксил, атом становится асимметрическим. Циклические диастереоизомеры, отличающиеся только положением гликозидного гидроксила, называются аномерами.
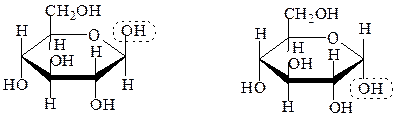
β,D-глюкопираноза α,D-глюкопираноза
При нумерации атомов по часовой стрелке для D-ряда, или против – для L-ряда, аномеры с расположением гликозидного гидроксила под и над плоскостью цикла принято обозначать буквами «a» или «b», соответственно:
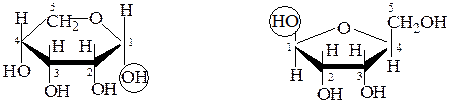
a,D-рибопираноза b,L-рибофураноза
Для D-рибозы можно составить формулы 4 циклических таутомеров. В природных соединениях рибоза и фруктоза существуют обычно в виде фуранозных форм, остальные пентозы и гексозы имеют, главным образом, пиранозный цикл.
Ниже представлено построение пиранозных и фуранозных форм D-глюкозы:
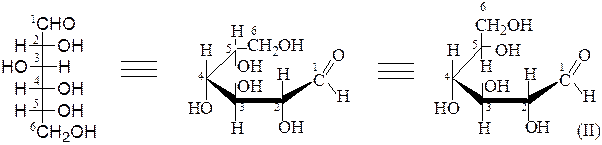
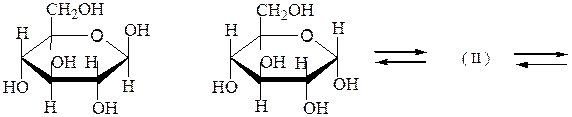
b,D-глюкопираноза a,D-глюкопираноза
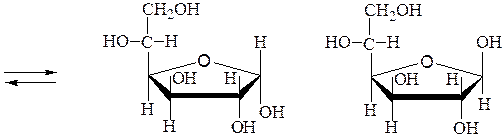
a,D-глюкофураноза b,D-глюкофураноза
Таким образом, алгоритм построения перспективных формул Хеуорса,исходя из формул Фишера,выглядит следующим образом:
1. Монозу изображают в виде проекционной формулы Фишера с нумерацией углеродной цепи и выделением атома углерода, гидроксильная группа которого будет участвовать в образовании цикла.
|
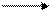
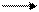 3. Преобразованную формулу Фишера поворачивают на 90° вправо, располагают ее горизонтально и представляют в виде незавершенного пяти- или шестичленного цикла
3. Преобразованную формулу Фишера поворачивают на 90° вправо, располагают ее горизонтально и представляют в виде незавершенного пяти- или шестичленного цикла
|
4. Замыкают цикл между гидроксильной и карбонильной группами с образованием при углероде карбонильной группы новой гидроксильной группы (полуацетальная).
5. В циклической структуре углеродную цепь нумеруют по
часовой стрелке, соответственно нумерации в формуле Фишера (кислород не
нумеруют!).
6. Заполняют циклическую структуру с расположением заместителей
перпендикулярно плоскости кольца по системе: заместители, находящиеся в формуле Фишера слева, изображают вверху, над кольцом, заместители, расположенные в формуле Фишера справа, – внизу, под кольцом.
7. Определяют конфигурацию полуацетальной гидроксильной (гликозидной) группы. В формулах Хеуорса полуацетальный гидроксил у α-аномеров D-ряда располагается внизу, у β-аномеров D-ряда – вверху над условно плоским кольцом. Для моноз L-ряда – все наоборот.
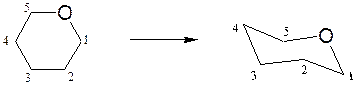
Конформации моносахаридов. Формулы Хеуорса, несмотря на преимущества по сравнению с формулами Фишера, в целом не отражают истинного пространственного строения циклических форм моносахаридов. Если пятичленный цикл близок к плоской форме и формулы Хеуорса достаточно удовлетворительно описывают строение фураноз, то пиранозы имеют в основном конформацию «кресло». Переход от формулы Хеуорса к конформации кресла пиранозы осуществляется следующим образом:
– плоский цикл Хеуорса превращают в форму кресла с атомом кислорода в верхнем правом углу:
– α-аномер изображают размещением гликозидного гидроксила в аксиальном (а) положении, β-аномер – ОН в экваториальном (е) положении:
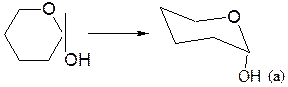
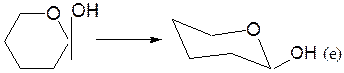
– заместители, находящиеся в цис- или транс-положении, по отношению к гликозидному гидроксилу, занимают, соответственно, экваториальное или аксиальное положение.
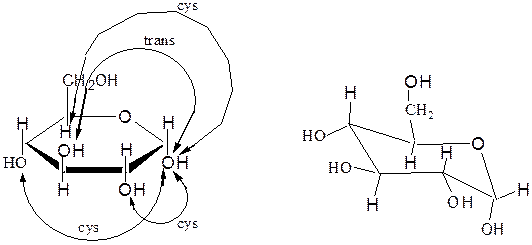
α,D-глюкопираноза
Таким образом, моносахариды могут существовать в нескольких структурных формах: открытой – оксоформе, циклической пятичленной и циклической шестичленной формах. В растворах данные формы находятся в динамическом равновесии и называются таутомерными.
Кольчато-цепная таутомерия моносахаридов. Таутомерия – изомерия, при которой происходит быстрое обратимое самопроизвольное взаимное превращение структурных изомеров - таутомеров. Для углеводов такой вид таутомерии называется цикло-оксо-таутомерией или кольчато-цепной таутомерией. Таутомерия – химическая основа явления мутаротации.
Мутаротация - самопроизвольное изменение во времени угла вращения плоскости поляризованного света свежеприготовленными растворами углеводов до постоянной величины. В растворах моносахариды существуют в виде равновесной смеси всех возможных таутомерных форм, включая α- и β-аномеры пиранозных и фуранозных форм, и оксо-формы. При установившемся равновесии вещество содержит одновременно молекулы таутомеров в определенном соотношении с преобладанием термодинамически устойчивого соединения. Например, для D-глюкозы:

a,D-глюкопираноза b,D-глюкопираноза
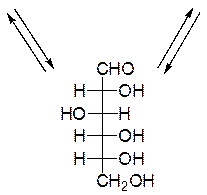
аль-D-глюкоза
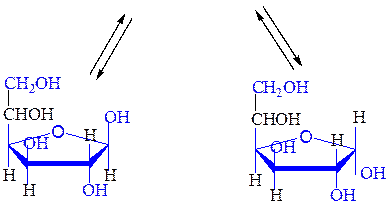
b,D-глюкофураноза a,D-глюкофураноза
Физические свойстваМоносахариды (монозы) – бесцветные кристаллические вещества, растворимые в воде и диметилсульфоксиде, трудно – в этаноле, не растворяются в органических растворителях. В кристаллическом индивидуальном состоянии монозы представляют собой внутренние циклические полуацетали. Важнейшими физико-химическими характеристиками моноз являются удельное вращение, спектры протонного магнитного резонанса, рентгеноструктурный анализ кристаллов и температура плавления Наряду с хроматографическими методами анализа, физические характеристики используются для идентификации природных моносахаридов.
Дата добавления: 2017-09-19; просмотров: 2575;