Химические свойства
1. Меркаптаны обладают более сильными кислотными свойствами, чем спирты и фенолы. Тиоспирты реагируют со щелочами, а также оксидами тяжелых металлов, образуя меркаптиды:
СH3CH2CH2SH + NaOH → CH3CH2CH2SNa + H2O
2 CH3CH2SH +HgO → (CH3CH2S) 2Hg + H2O
Меркаптиды можно алкилировать и ацилировать:
СH3CH2SNa + CH3I → СH3CH2 – S – CH3 + NaI
метилэтилсульфид
СH3CH2SNa + CH3СOCl → СH3COSСH2CH3 + NaI
этилтиоацетат
2. Тиоспирты значительно активнее, чем обычные спирты, реагируют с альдегидами и кетонами, образуя тиоацетали и тиокетали:
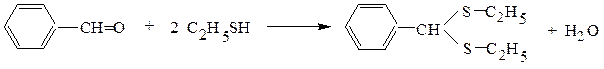
диэтилтиоацеталь бензальдегида

этилентиокеталь циклопентанона
3. Меркаптаны легко окисляются. Такие слабые окислители, как серная кислота, йод и даже кислород воздуха, окисляют их до дисульфидов:
2 R – SH + I2 → R – S – S – R + 2 HI
Сильные окислители превращают меркаптаны в сульфокислоты:
C2H5SH + K2Cr2O7 → C2H5SO3H
этансульфокислота
СУЛЬФИДЫ (ТИОЭФИРЫ)
Простые тиоэфиры называют сульфидами. Их можно получить из галогеналканов и сульфидов щелочных металлов:
2 CH3CH2Br + K2S → СH3CH2 – S – CH2CH3 + 2 KBr
Сульфиды образуются также при перегонке меркаптидов свинца:
(CH3S) 2Pb → (CH3) 2S + PbS
Низшие тиоэфиры представляют собой жидкости, нерастворимые в воде и кипящие выше, чем меркаптаны. Запах чистых сульфидов не является неприятным, напоминает запах эфира.
К тиоэфирам относится и известное отравляющее вещество «иприт» – β,β'-дихлордиэтилсульфид. Его получали из этилена и однохлористой серы:
2 CH2=CH2 + S2Cl2 → Cl – CH2CH2 – S – CH2CH2 – Cl + S
Химические свойства сульфидов обусловлены склонностью двухвалентной серы к переходу в высшие валентные состояния.
50%-ная азотная кислота окисляет тиоэфиры в сульфоксиды:
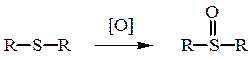
Диметилсульфоксид – один из наиболее применяемых высоко-полярных растворителей.
Более сильные окислители (конц. HNO3, КMnO4) окисляют сульфиды и сульфоксиды до сульфонов.
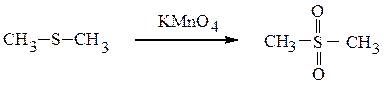
диметилсульфон
Сульфоны – твердые кристаллические вещества. Некоторые сульфоксиды и сульфоны применяются в лекарственных средствах.
Полисульфоны являются негорючими полимерами. Некоторые из них могут быть получены взаимодействием олефинов с оксидом серы (IV):

При алкилировании тиоспиртов галогеналканами или эфирами серной кислоты образуются сульфониевые соли:
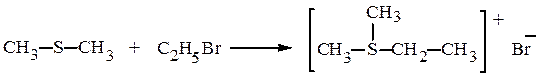
Бромистый диметилэтилсульфоний и другие сульфониевые соли растворимы в воде. Их свойства подобны свойствам четвертичных аммониевых соединений.
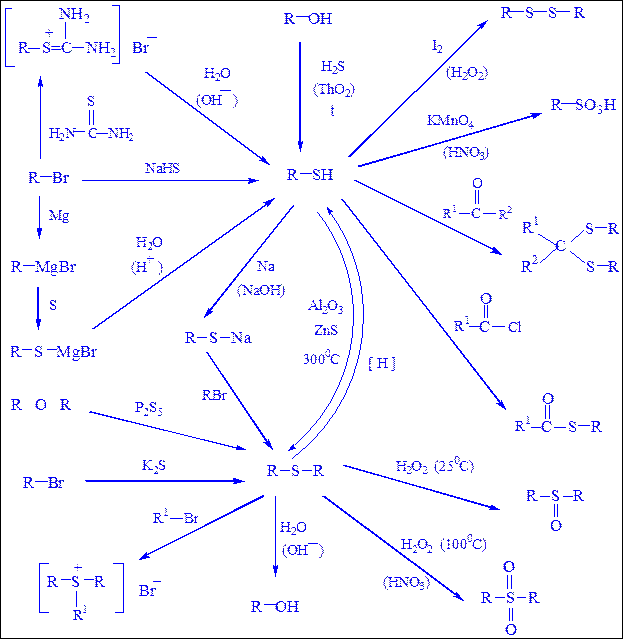
Схема 20. Синтез и химические реакции меркаптанов и сульфидов.
Сульфокислоты
Сульфокислоты (или сульфоновые кислоты) – органические соединения, молекулы которых содержат сульфогруппу SO3H, непосредственно связанную с атомом углерода.
Способы получения
1. Прямое сульфирование углеводородов обычно применяется для получения ароматических сульфокислот. Сам бензол и его производные, содержащие в ядре заместители-акцепторы, сульфируются олеумом:
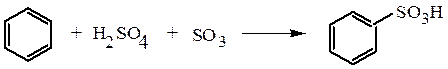
Гомологи бензола и нафталин сульфируются концентрированной серной кислотой:

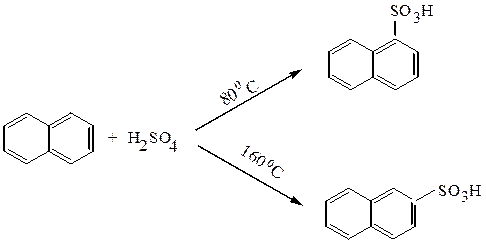
Прямое сульфирование алканов возможно лишь при наличии в молекуле третичного атома углерода:
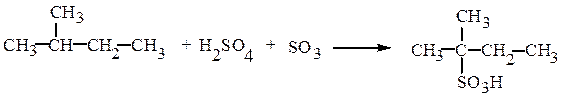
2-метилбутан-2-сульфокислота
Некоторые алифатические сульфокислоты могут быть получены сульфоокислением алканов (на свету), однако эта реакция мало изучена и практического применения пока не нашла:
R – H + SO2 + O2 → R – SO3H
2. Окисление меркаптанов:
R – SH + [ O ] → R – SO3H
Способ имеет ограниченное применение, так как исходные меркаптаны не дешевы.
3. Реакция галогеналканов с сульфитом натрия:
CH3CH2Br + Na2SO3 → CH3CH2SO2ONa + NaBr
натрийэтилсульфонат
4. Присоединение гидросульфита натрия по двойным связям:
R – CH=CH2 + NaHSO3 → R – CH – SO3Na
│
CH3
Таким образом в промышленности получают смеси высших алкилсульфонатов.
Сульфокислоты представляют собой кристаллические вещества, хорошо растворимые в воде, весьма гигроскопичные.
Химические свойства ароматических сульфокислот(см. схему 21, с. 239).
1. Кислотные свойства.
Сульфокислоты по силе сравнимы с серной кислотой. При реакции с металлами, их оксидами и гидроксидами, а также с аммиаком и аминами образуют соли.
RSO3H + NaOH → RSO3Na + H2O
Соли сульфокислот, имеющие длинноцепочечный гидрофобный радикал, являются анионактивными поверхностно-активными веществами (АПАВ). Необходимым компонентом, практически, всех, выпускаемых в России стиральных порошков, является алкилбензолсульфонат натрия RC6H4SO3Na (торговое название «сульфонол»).
Сплавление солей сульфокислот со щелочами – основной способ получения фенолов:
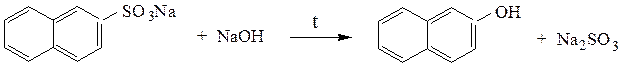
При сплавлении с цианидами образуются нитрилы:
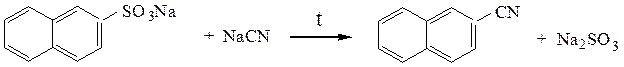
Схема 21. Синтез и химические свойства ароматических сульфокислот.

Дата добавления: 2017-09-19; просмотров: 8531;
