Химические свойства
1. Основность аминов обусловлена способностью атомов азота присоединять протон к неподеленной паре электронов с образованием катионов аммонийного типа. Основность аминов измеряется константой равновесия реакции гидратации:
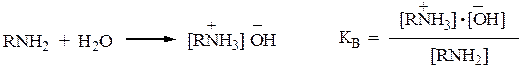
Основность амина тем выше, чем больше электронная плотность сосредоточена на атоме азота. Благодаря +I-эффекту алкильной группы алифатические амины (особенно третичные) имеют большую электронную плотность на атоме N, чем аммиак, и следовательно, большую основность.
Таблица 19. Зависимость константы основности от типа амина
| NH3 | CH3NH2 | C2H5NH2 | (C2H5)2NH |
| |
| Кв | 1,8 ·10-5 | 4,4 ·10-4 | 4,7 ·10-4 | 9,5 ·10-4 | 1,6 ·10-3 |
Таблица 20. Физические свойства аминов
| Название | формула | Т.пл. / Т.кип. (0 С) | Кв |
| Метиламин Диметиламин Триметиламин Этиламин Диэтиламин Триэтиламин Пропиламин Дипропиламин Трипропиламин Изопропиламин Бутиламин Изобутиламин Вторбутиламин третбутиламин Циклогексиламин Бензиламин α-Фенилэтиламин β-Фенилэтиламин Тетраметилендиамин Гексаметилендиамин Анилин N-Метиланилин N,N-Диметиланилин Дифениламин Трифениламин о-толуидин м-толуидин п-толуидин о-анизидин м-анизидин п-анизидин о-нитроанилин м-нитроанилин п-нитроанилин 2,4-динитроанилин 2,4,6-тринитроанилин о-фенилендиамин м-фенилендиамин п фенилендиамин Бензидин | CH3NH2 (CH3)2NH (CH3)3N CH3CH2NH2 (CH3CH2)2NH (CH3CH2)3N CH3CH2CH2NH2 (CH3CH2CH2)2NH (CH3CH2CH2)3N (CH3)2CHNH2 CH3(CH2)3NH2 (CH3)2CHCH2NH2 CH3CH2CH(CH3)NH2 (CH3)3CNH2 С6H11NH2 С6H5CH2NH2 С6H5CH(CH3)NH2 С6H5CH2CH2NH2 H2N(CH2)4NH2 H2N(CH2)6NH2 С6H5NH2 С6H5NHСН3 С6H5N(СН3)2 (С6H5)2NH (С6H5)3N o-СН3С6Н4NН2 м-СН3С6Н4NН2 п-СН3С6Н4NН2 o-СН3ОС6Н4NН2 м-СН3ОС6Н4NН2 п-СН3ОС6Н4NН2 o-NО2С6Н4NН2 м- NО2С6Н4NН2 п-NO2С6Н4NН2 2,4-(NO2)2С6Н3NН2 2,4,6-(NO2)3С6Н2NН2 o-С6Н4(NН2)2 м-С6Н4(NН2)2 п-С6Н4(NН2)2 п -NН2С6Н4С6Н4NН2-п | - 92 / - 7,5 - 96 / 7,5 - 117 / 3 - 80 / 17 - 39 / 55 - 115 / 89 - 83 / 49 - 63 / 110 - 93 / 157 - 101 / 34 - 50 / 78 - 85 / 68 - 104 / 63 ─ / 134 - 67 / 4 ─ / 185 ─ / 187 / / 195 8 / 117 39 / 196 - 6 / 184 - 57 / 196 3 / 194 53 / 302 127 / 365 - 28 / 200 - 30 / 203 44 / 200 5 / 225 ─ / 251 57 / 244 71 / 284 114 / 307 (разл.) 148 / 332 187 / ─ 188 / ─ 104 / 251 63 / 287 142 / 267 127 / 401 | 4,4 . 10 -4 5,1 . 10 -4 0,6 . 10 -4 4,7 . 10 -4 9,5 . 10 -4 5,5 . 10 -4 3,8 . 10 -4 8,1 . 10 -4 4,5 . 10 -4 4,1 . 10 -4 0,23 . 10 -4 4,2 . 10 -10 7,1 . 10 -10 11 . 10 -10 0,7 . 10 -10 2,5 . 10 -10 4,9 . 10 -10 12 . 10 -10 3 . 10 -10 2 . 10 -10 15 . 10 -10 3,5 . 10 -14 3,2 . 10 -12 0,1 . 10 -12 3,3 . 10 -10 7,6 . 10 -10 11 . 10 -10 7,4 . 10 -13 |
Ароматические амины вследствие сопряжения неподеленной пары электронов азота с p-электронным облаком бензольного ядра являются более слабыми основаниями, причем этот эффект усиливается при введении в ароматическое кольцо электроноакцепторных группировок..С увеличением объемов заместителей, окружающих реакционный центр вещества, возрастают пространственные препятствия для его атаки молекулой реагента. Это также относится и к протонированию аминов. В связи с этим амины, содержащие большие радикалы, проявляют более слабые основные свойства по сравнению с ожидаемыми при рассмотрении только электронных эффектов радикалов, окружающих атом азота.
Дата добавления: 2017-09-19; просмотров: 1494;
