АЗО- И ДИАЗОСОЕДИНЕНИЯ
Диазотирование– это способ получения ароматических диазосоединений из первичных ароматических аминов и смеси нитрита натрия и минеральной кислоты. Поскольку реакция экзотермичная, а образующиеся соли диазония при нагревании разлагаются, то реакционная смесь охлаждается до 0-5 °С добавлением льда в реакционную массу.
ArNH2 + КNO2 + 2 HCl ¾® ArN2+X- + КCl + 2 H2O
Конец диазотирования определяется по посинению бумаги, пропитанной растворами KI и крахмала (йодо-крахмальная бумага). Азотистая кислота, находящаяся в избытке, окисляет I- до свободного иода, вызывающего появление характерной окраски крахмала.
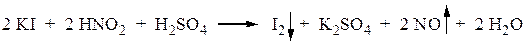
Соли диазония готовят непосредственно перед использованием. Повышение температуры способствует их распаду с выделением азота и отражается на чистоте и выходе продуктов дальнейших превращений. Избыток азотистой кислоты нежелателен, т.к. возможно нитрозирование азосостав-ляющей и конкуренция с реакцией азосочетания. Его можно устранить добавлением в реакционную массу после диазотирования сухой мочевины или сульфаминовой кислоты до прекращения выделения газов:
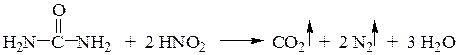

Электронодонорные заместители, увеличивающие электронную плотность в ароматическом ядре, стабилизируют арилдиазоний-катион. Диазониевая группа легко замещается на другие функциональные группы с образованием ароматических веществ различных классов, а также на атом водорода, приводящий к ее элиминированию. Во всех реакциях выделяется азот, последняя реакция завершает цепь превращений, в которых используется ориентирующее действие нитро- или аминогруппы, превращающуюся затем в диазониевую. Метод использования солей диазония для синтезов ароматических соединений различных классов удобен в связи с пониженной реакционной способностью арилгалогенидовв реакциях нуклеофильного замещения атома галогена их применение для синтеза производных ароматического ряда. Особая ценность диазониевой группы заключается не только в разнообразии реакций замещения, но и возможности элиминироваться, замещаться на водород. Последняя реакция обычно завершает цепь превращений, в которых используется ориентирующее действие нитро- или аминогруппы, превращаемой затем в диазониевую.
Для получения азокрасителей используют реакции солей диазония с ароматическими фенолами и аминами (реакция азосочетания) (схема 19):
Схема 19. Химические свойства солей диазония
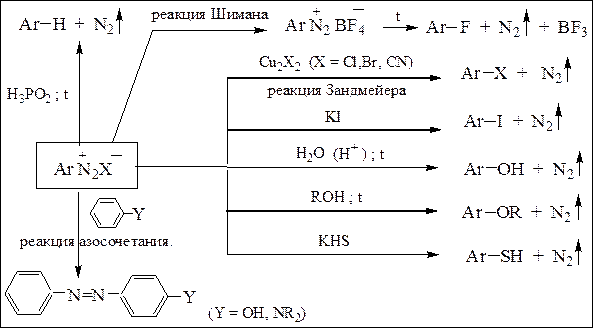
Реакция азосочетания. Реакция азосочетания является реакцией электрофильного замещения (SE.), так как электроноакцепторные группы увеличивают, а электронодонорные группы снижают реакционную способность арилдиазоний-катиона. Реакция протекает в пара-положение, а если оно занято – то в орто-положение. Электрофильный характер азосочетания подтверждается и тем, что при увеличении электронодонорности заместителей в ароматическом ядре скорость реакции возрастает.Ароматические соединения, не содержащие в ядре сильных электронодонорных заместителей, как правило, не могут выступать в роли азокомпонентов
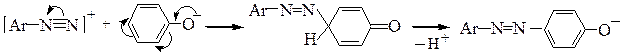
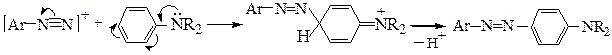
В сильнокислой среде возможно протонирование групп азокомпонентов (-ОН, -NR2), обусловливающих их повышенную реакционную способность; при этом азокомпоненты утрачивают свою способность к азосочетанию:
При рН > 10 из диазосоставляющей образуется диазотат-анион, не обладающий электрофильными свойствами:
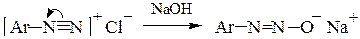
Фенолы наиболее активны в роли азокомпонентов в реакциях азосочетания в форме фенолят-аниона, а амины - в непротонированной форме.
При азосочетании возможны следующие побочные реакции:
– разложение диазосоединения с выделением азота, скорость процесса при этом возрастает с повышением температуры и рН среды;
– переход диазосоединения в неактивный диазотат-анион Ar-N=N-О- (обычно в сильнощелочной среде);
– образование диазоаминосоединения при использовании в качестве азосоставляющего компонента амина. Реакция может быть основной при диазотировании недостатком азотистой кислоты в нейтральной или щелочной среде:
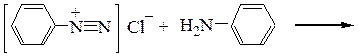
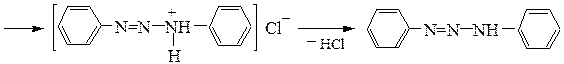
Диазоаминобензол
В зависимости от рН среды азокрасители приобретают различную окраску, Так, индикаторные свойства метилоранжа обусловлены таутомерией: в щелочной среде он желтого цвета (бензоидная форма), в кислой - красного (хиноидная форма).
Контрольные вопросы к главе 15 «Органические соединения азота»
№ 1.Охарактеризуйте достоинства, недостатки и области применения основных методов синтеза аминов. Какие продукты образуются при восстановлении п-нитротолуола в кислой, нейтральной и щелочной средах?
№ 2.Чем обусловлены основные свойства аминов? Что называется константой основности амина Кв? Как на основность аминов влияют электронные и пространственные факторы? Расположите соединения в ряд по увеличению значения КB : (а)метиламин, дифениламин, анилин, аммиак; (б)анилин, п-нитроанилин, N,N-диметиланилин, N-метиланилин; (в)аммиак, циклогексиламин, триэтиламин, анилин; (г)метиламин, диметиламин, аммиак, триметиламин; (д)п-толуидин, анилин, аммиак, п-нитроанилин, 2,4,6-тринитроанилин.
№ 3.Для лечения сердечной аритмии используют гидрохлорид новокаинамида 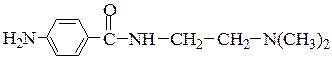 . Определите место протонирования в молекуле этого препарата.
. Определите место протонирования в молекуле этого препарата.
№ 4.Напишите уравнения реакций и назовите продукты: (а) ацетамида с алюмогидридом лития; (б) анилина с серной кислотой при нагревании; (в) этиламина с п-толуолсульфохлоридом; (г) 1-нафтиламина с уксусным ангидридом; (д) термического разложения гидроксида триметилвторбутил-аммония; (е) третбутиламина с азотистой кислотой
№ 5.Решите следующие цепочки превращений:
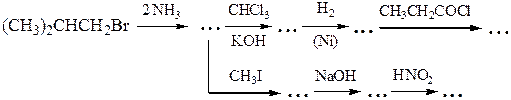
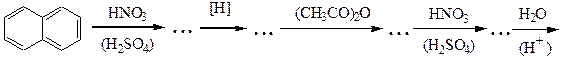
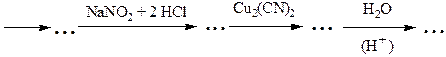
№ 6.Почему диазотирование ароматических аминов проводят при низкой температуре? Как определить конец диазотирования? Как после диазотирования удалить из реакционной смеси избыток азотистой кислоты? Почему нежелателен ее избыток? Почему азосочетание проводят при рН 5-9 (с фенолами - в слабощелочной, а с аминами - в слабокислой среде)? Какие осложнения возникнут, если рН не поддерживать в указанных пределах?
№ 7.Из каких исходных соединений в результате диазотирования и азосочетания были получены следующие азокрасители:
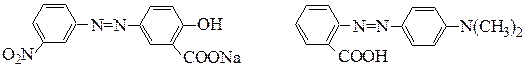
ализариновый желтый метиловый красный
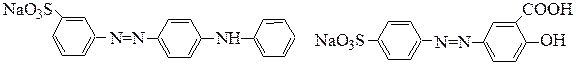 кислотный желтый метаниловый кислотный хром желтый Н
кислотный желтый метаниловый кислотный хром желтый Н
№ 8.Предложите схемы синтеза:(а) изопропиламина методом Габриэля; (б)этиламина из бромистого пропила; (в)1-аминопентана из валериановой кислоты; (г) циклогексиламина из циклогексанона; (д) 1,4-диаминобутана из адипиновой кислоты; (е) азотистого иприта N(CH2CH2C1)3 из этилена.
№ 9. Предложите схемы синтеза следующих веществ, используя свойства солей диазония: (а) п-бромбензойной кислоты из п-толуидина; (б) 4,4'-дииоддифенила из бензидина; (в) 2,4,6-триметилфенола из мезитилена (1,3,5-триметилбензола); (г) 1-нафталинкарбоновой кислоты из 1-нитро-нафталина; (д) о-хлортолуола из п-нитротолуола.
№ 10.Установите строение веществ: (а)C7H7NO2, при окислении дает кислоту, а при восстановлении, диазотировании и нагревании с Сu2С12 образует о-хлортолуол; (б)C7H9N, при диазотировании, последующем нагревании с Cu2(CN)2 и гидролизе дает кислоту, при мононитровании которой образуется только один изомер; (в)C7H10N2, при действии азотистой кислоты и нагревании с Сu2С12 дает п-хлорбензиловый спирт;(г)С6Н10О, с гидроксиламином дает производное, которое в кислой среде изомерируется в капролактам; (д) С6Н5Вг2NО3S, после диазотирования и нагревания образует C6H4Br2O3S. Последнее при обработке перегретым паром превращается в м-дибромбензол. Исходное вещество может быть получено с хорошим выходом из сульфаниловой кислоты (п-аминобензолсульфокислоты).
Дата добавления: 2017-09-19; просмотров: 5652;
