Отдельные представители
Молочная кислота.Образуется в квашеных продуктах (моченые яблоки, капуста, огурцы) при молочнокислом брожении сахаров бактерииями родов Lactobacillus и Streptococcus: С6H12O6 (D–глюкоза) ¾® 2 CH3CH(OH)COOH. Существует в двух оптически активных (D и L и неактивной рацемической формы. Рацемическая форма представляет молочную кислоту брожения. L-(+)-молочная кислота образуется в мышцах как продукт превращения гликогена. D-(–)-молочная кислота может быть получена под действием микроорганизмов. Соли и сложные эфиры молочной кислоты называются лактатами.
Яблочная кислота содержится в незрелых яблоках, рябине, барбарисе. Существует в виде двух энантиомеров и рацемата.

D-(+)-яблочная кислота L-(-)-яблочная кислота
2-(R)-гидроксибутандиовая кислота 2-(S)-гидроксибутандиовая кислота
Винная кислота. Содержит два асимметрических атома углерода. Согласно формуле N= 2n, должна бы существовать в виде 4 конфигурационных стереоизомеров, однако вследствие наличия плоскости симметрии два из них одинаковые и оптически неактивные (табл. ). D-винная кислота содержится в виноградном соке; в процессе приготовления вина она накапливается в виде малорастворимого гидротартрата калия и часто образует осадок – «винный камень». Двойная соль – калийнатрийтартрат (сегнетова соль), подобно вицинальным диолам, способна образовывать с голубым осадком Cu(OH)2 растворимое в воде комплексное соединение темно-синего цвета. Оно используется для идентификации альдегидов и называется жидкостью Фелинга (см. с. 142).
Контрольные вопросы к главе 13 «Гидроксикислоты»
№ 1.Какие нужно взять исходные вещества, чтобы синтезировать по методу Реформатского: (а) 3-гидрокси-3-метилбутановую кислоту; (б) 3-гидрокси-3-метилпентановую кислоту; (в) b-гидрокси-b-фенилмасляную кислоту; (г) b-гидрокси-b-фенил-a-метилпропионовую кислоту?
Таблица 18. Стереоизомеры винной кислоты
D-(+)- или 2R,3R-винная кислота
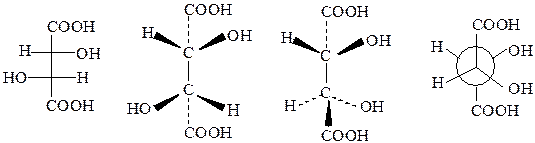 т.пл. 170 °С ; [ α ]D (25 °C, 20%-ный р-р) = + 12°; растворимость при 20 °С –
139 г в 100 г воды; К1 = 1,17·10─3 , К2 = 5,9·10─-5
т.пл. 170 °С ; [ α ]D (25 °C, 20%-ный р-р) = + 12°; растворимость при 20 °С –
139 г в 100 г воды; К1 = 1,17·10─3 , К2 = 5,9·10─-5
|
L-(─)- или 2S,3S-винная кислота
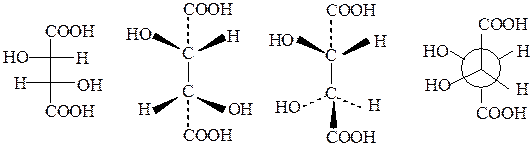 т.пл. 170 °С ; [ α ]D (25°C, 20%-ный р-р) = ─ 12°; растворимость при 20 °С–
139 г в 100 г воды; К1 = 1,17·10─3 , К2 = 5,9·10─5
т.пл. 170 °С ; [ α ]D (25°C, 20%-ный р-р) = ─ 12°; растворимость при 20 °С–
139 г в 100 г воды; К1 = 1,17·10─3 , К2 = 5,9·10─5
|
| виноградная кислота [рацемическая смесь – DL-( + )-винная кислота]: т.пл. 206 °С ; [α]D (25C, 20%-ный р-р) = 0 0 (оптически неактивна); растворимость при 200С– 20,5 г в 100 г воды; К1 = 1.1·10─3 , К2 = 5.8·10─5 |
2R,3S-винная кислота (мезовинная кислота)
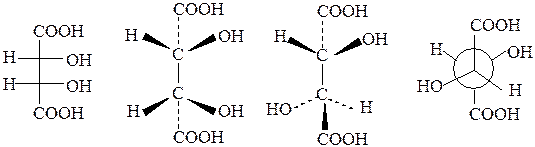 т.пл. 140 0С ; [α]D (250C, 20%-ный р-р) = 0 0 (оптически неактивна);
растворимость при 200С– 125 г в 100 г воды; К1 = 0.77·10─3 , К2 = 1.6·10─5
т.пл. 140 0С ; [α]D (250C, 20%-ный р-р) = 0 0 (оптически неактивна);
растворимость при 200С– 125 г в 100 г воды; К1 = 0.77·10─3 , К2 = 1.6·10─5
|
№ 2.Напишите уравнения реакций салициловой кислотыс реагентами, взятыми в избытке: (а) пропионовым ангидридом, (б) гидроксидом натрия, (в) этанолом, (г) хлористым тионилом, (д) аммиаком, (е) натрием.
№ 3.Дайте определения понятиям: «оптически активное соединение», «хиральный центр», «диастереомеры», «энантиомеры», «рацемат», «мезо-соединение». Изобразите проекционные формулы Фишера (где возможно) для D- и L-изомеров: (а) диметилового эфира яблочной кислоты; (б) диэтилового эфира винной кислоты; (в) изобутилового эфира α-гидрокси-изомасляной кислоты.
№ 4.Какие гидроксикислоты при нагревании образуют следующие соединения:
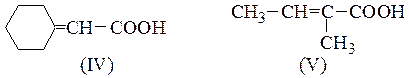
№ 5.Как с помощью химических проб различить изомерные вещества: (а) миндальную и салициловую кислоты; (б) метиловый эфир гликолевой кислоты и метоксиуксусную кислоту?
№ 6.Определите строение веществ по молекулярной формуле и продуктам реакций: (а)С8Н8О3, растворяется в воде и водной щелочи, образует сложные эфиры с кислотами и спиртами, не дает реакции с FеС13, реагирует с РС15, образуя вещество С8Н6ОС1. Имеет два оптических изомера;(б)С6Н12О3, оптически деятельно, с основаниями образует соль, при нагревании дает соединение C6H10O2, которое, окисляясь KMnO4 при нагревании, превращается в смесь изомасляной и щавелевой кислот; (в)C9H10O3 (троповая кислота), получают из алкалоида атропина, находящегося в Atropa belladonne, при окислении KMnO4 в кислом растворе дает бензойную кислоту, реагирует с одним эквивалентом NaOH и двумя Na;(г)С4Н8О3, водный раствор имеет рН < 7, обладает оптической активностью, при действии НС1 образует С4Н7О2С1, а при обработке РС15 - С4Н6ОС12, может быть получено циангидридным синтезом из карбонильного соединения
№ 7.Cинтезируйте: (а) молочную кислоту из этанола; (б) a-гидрокси-изомасляную кислоту из пропилена; (в) винную кислоту из бензола; (г) метилсалицилат (метиловый эфир о-гидроксибензойной кислоты) из о-крезола (2-метилфенола); (д) лимонную кислоту из хлоруксусной кислоты.
ОКСОКИСЛОТЫ
Определение. Оксокислотами называются соединения, содержащие наряду с карбоксильной группой оксогруппу, т.е. это альдегидо- или кетонокислоты.
Классификация.Оксокислоты могут содержать одну, две и более карбонильных или карбоксильных групп. По взаимному расположению функциональных групп различают α-, β-,γ- и др. оксокислоты.
Номенклатура.В названиях альдегидо- и кетонокислот наличие карбонильной группы обозначают приставкой «оксо-». Для некоторых оксокислот используются тривиальные названия (пировиноградная, левулиновая), а для оксокислот, участвующих в биохимических циклах в живых организмах, используются традиционно сложившиеся в биохимической литературе названия – ацетоуксусная, щавелевоуксусная, кетоглутаровая и др.
Способы получения. К общим методам синтеза оксокислот относятся гидролиз гем-дигалогензамещенных кислот и окисление гидроксикислот:
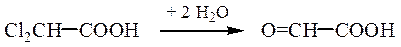
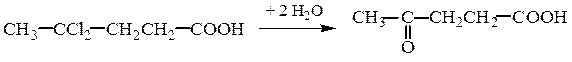
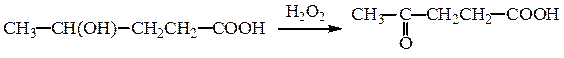
α-Оксокислоты образуются при гидролизе α-оксонитрилов, которые могут быть получены из хлорангидридов карбоновых кислот и солей синильной кислоты, например при использовании цианида меди (I):
R–C=O Cu2(CN)2 R–C=O H2O R–C=O
│ ¾¾¾¾¾¾® │ ¾¾¾¾¾® │
Cl CN OH
Пировиноградную кислоту можно получить из винной кислоты, которая при нагревании теряет воду и декарбоксилируется,а ацетондикарбоновую кислоту – из лимонной кислоты при действии олеума в результате дегидрата-ции и декарбонилирования. β-Оксокислоты разлагаются при попытке выделить их в свободном состоянии.(ацетоуксусная кислота легко декарбоксилируется, чему способствует образование внутримолекулярной водородной связи):
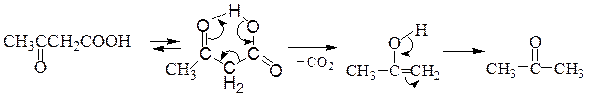
В связи с этим β-оксокислоты обычно получают в виде стабильных сложных эфиров с помощью сложноэфирной конденсации по Кляйзену, которая протекает протекает по схеме:
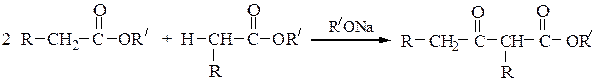
Механизм конденсации Кляйзена следующий:
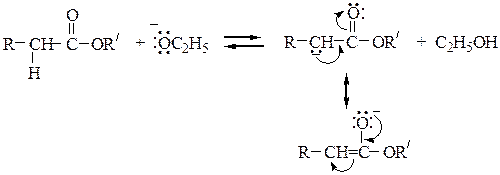
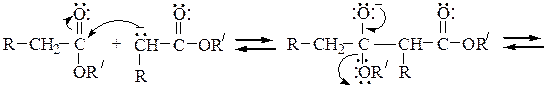
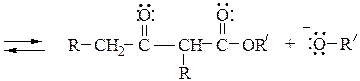
Перекрестной сложноэфирной конденсацией по Кляйзену между этилокса-латом (карбонильная компонента) и этилацетатом (метиленовая компонента) синтезируют эфир щавелевоуксусной кислоты (этилоксалоацетат):
СOOC2H5 C2H5ONa C2H5OOC–C–CH2–COOC2H5
│ +CH3 – COOC2H5¾¾¾¾¾® ║
СOOC2H5 (– C2H5OH) O
Дата добавления: 2017-09-19; просмотров: 1064;
