Химические свойства
Оксокислоты проявляют свойства, характерные как для карбоновых кислот, так и для альдегидов и кетонов. Оксокислоты образуют производные по карбоксильной группе – соли, сложные эфиры, амиды и др., по карбонильной группе – оксинитрилы, оксимы, гидразоны и т.д. Химические свойства оксокислот существенно зависят от взаимного расположения функциональных групп, поскольку обе группы оказывают влияние друг на друга. При близком расположении наблюдается взаимное усиление электрофильных свойств атомов углерода карбонильной и карбоксильной групп, что приводит к усилению их реакционной способности при взаимодействии с нуклеофилами.
Некоторые α-оксокислоты, у которых карбонильная группа находится рядом с электроноакцепторной карбоксильной группой, легко присоединяют даже слабые нуклеофилы, например, воду, и образуют гидратные формы:
COOH COOH
│ │
C=O + H2O ¾¾¾® HO–C–OH
│ │
COOH COOH
Кислотные свойства оксокислот снижаются по мере удаления электроно-акцепторной оксогруппы от карбоксильной вследствие затухания – I эфф.
Под действием разбавленных минеральных кислот α-оксокислоты подвергаются декарбоксилированию, а нагревание с концентрированной серной кислотой приводит к карбонилированию, т.е. отщеплению оксида углерода (II):
H2SO4 (конц.) H2SO4 (разб.)
CH3COOH + CO ←¾¾¾─¾ CH3–CO–COOH ¾¾¾¾¾® CH3–CHO + CO2
β-Оксокислоты среди оксокислот имеют наибольшее практическое значение. Специфика их химических свойств обусловлена наличием сильного СН-кислотного центра, возникновение которого связано с β-расположением двух электроноакцепторных функциональных групп. В ряду β-оксокислот (также β-кетоэфиров и β-дикетонов) проявляется кето-енольная таутомерия. Таутомерия – способность химических соединений существовать в виде двух или нескольких, находящихся в равновесии, структурных изомеров.
β-Оксокислоты неустойчивы и легко декарбоксилируются, чему способ-ствует образование внутримолекулярной водородной связи (см. выше). Поэтому вместо них используют сложные эфиры, например ацетоуксусный эфир, получаемые конденсацией по Кляйзену исходя из этилацетата (R = H). Вследствие кето-енольной ацетоуксусный эфир существует в виде равновесной смеси двух форм – кетонной и енольной, легко переходящих одна в другую:

кетонная форма (92,5 %) енольная форма (7,5 %)
Обычно енолы неустойчивы, однако в случае b-дикарбонильных соединений (β-дикетоны, β-кетоэфиры) большая устойчивость енольных форм объясняется стабилизацией за счет сопряжения связей С=С и С=О в устойчивой шести-членной циклической структуре, образованной внутримолекулярной водород-ной связью между енольным гидроксилом и кислородом карбонильной группы:
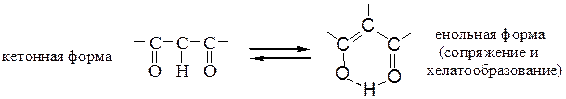
Содержание енольной формы увеличивается в среде неполярных растворителей (гексан > эфир > этанол).
В реакциях ацетоуксусный эфир проявляет двойственную реакционную способность – свойство образовывать продукты реакций, соответствующие обеим таутомерным формам, реагируя в одних реакциях в виде кетонной формы, а в других – в виде енола:
Схема 17. Двойственная реакционная способность ацетоуксусного эфира
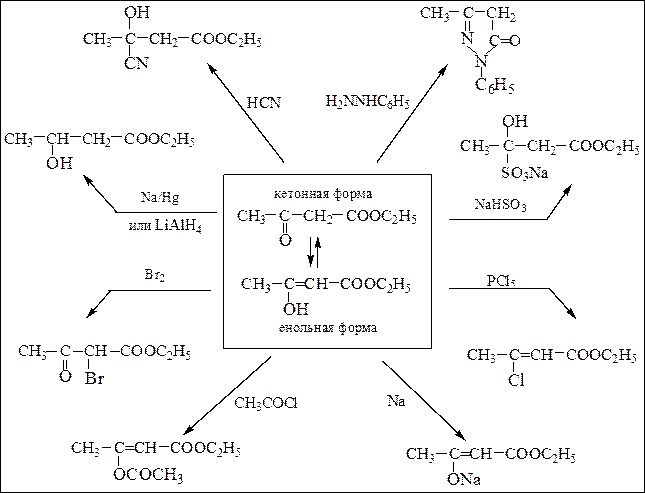
Синтезы на основе ацетоуксусного эфира. Ацетоуксусный эфир содержит СН2-группу в a-положении к двум карбонильным группам, поэтому атомы водорода метиленовой группы подвижны и отщепляются в виде протона под действием оснований. В полученном анионе заряд делокализован:
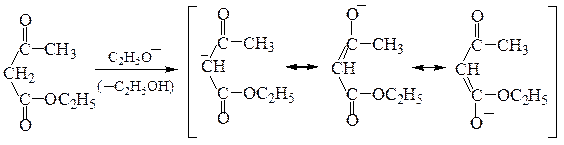
Полученный натрийацетоуксусный эфир при обработке галогеналканами вступает в реакцию С-алкилирования, причем алкилирование может быть проведено дважды:
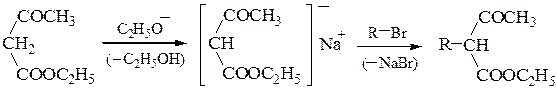
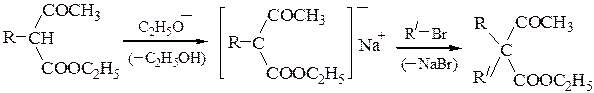
анион ацетоуксусного эфира является амбидентным нуклеофилом. Взаимодействие его с RHal приводит к образованию продуктов С- и О-алкили-рования (в зависимости от строения RHal и условий реакции). Как видно из приведенной выше схемы наибольшее значение имеют реакции С-алкили-рования, протекающие при реакции с RHal, способными вступать в реакции SN2. Монозамезамещенные ацетоуксусные эфиры обладают меньшей кислотностью; они лучше ионизируются более сильными основаниями, например, третбутилатом калия. Введение двух одинаковых заместителей проводят последовательно в два этапа, как и в случае различных заместителей.
В ацетоуксусном эфире и его алкильных производных в зависимости от условий реакции могут осуществляться два типа разрывов С-С-связи: кетонный (а) или кислотный (б) распад. При этом следует помнить, что
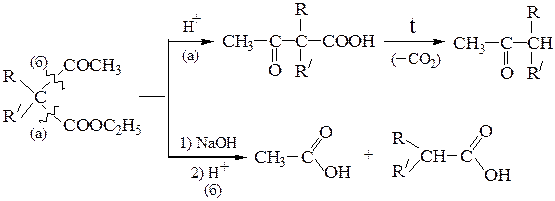
Таким образом, на основе ацетоуксусного эфира могут быть синте- зированы:
(а) кетоны общей формулы 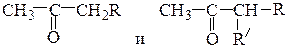
(соответственно одно или два алкилирования и кетонный распад);
(б) моно- и диалкилуксусные кислоты 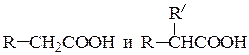
(соответственно одно или два алкилирования и кислотный распад);
(в) дикетоны и дикарбоновые кислоты по схеме:
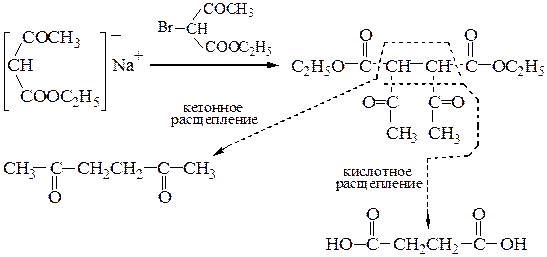
В этой схеме натрийацетоуксусный эфир может быть проалкилирован.
Контрольные вопросы к главе 14 «Оксокислоты»
№ 1.Напишите механизм сложноэфирной конденсации Кляйзена для этилового эфира пропионовой кислоты, приводящей к синтезу этилового эфира 2-метил-3-оксопентановой кислоты.
№ 2.Разберите механизм конденсации Дикмана диметилового эфира пимелиновой кислоты при катализе метилатом натрия:
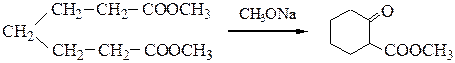
№ 3.Напишите уравнения реакций левулиновой кислоты (4-оксопен-тановой кислоты) с РС15, синильной кислотой, гидрокарбонатом натрия, гидроксиламином и метанолом (в присутствии НС1).
№ 4.Объясните опыт. При добавлении капли раствора FеС13 к водно-спиртовому раствору ацетоуксусного эфира появляется фиолетовая окраска. Если добавить бромную воду, то окраска исчезнет, но через некоторое время снова появится. Сколько моль брома практически может присоединиться к 1 моль ацетоуксусного эфира?
№ 5.Укажите факторы, влияющие на положение кето-енольного равновесия у b-дикарбонильных соединений. Почему ацетоуксусный эфир в обычных условиях енолизован на 7,5%, а диметилацетоуксусный эфир практически не енолизован? В каком растворителе (этаноле, гексане или эфире) ацетоуксусный эфир сильнее енолизован? В чем сходство и различие изомеров и таутомеров?
№ 6. Напишите уравнения реакций этилового эфира метилацетоуксусной кислоты (с учетом двойственной реакционной способности b-дикарбониль-ных соединений) с РС15, синильной кислотой, уксусным ангидридом, п-нитрофенилгидразином, кетонного и кислотного расщепления.
№ 7. Какие дикетоны при таутомерном равновесии (в виде чистой жидкости) содержат много енольной формы: диацетил, дибензоилметан, 5,5-диметилциклогександион-1,3 (димедон), ацетонилацетон, ацетилацетон,4-ме-тилциклопентандион-1,3, циклогександион-1,4, 3,3-диметилпентандион-2,4 ?
№ 8. Почему ацетоуксусная кислота легко декарбоксилируется?
№ 9. Какие дикетоны в таутомерном равновесии содержат много енольной формы: диацетил, дибензоилметан, 5,5-диметилциклогександион-1,3 (димедон), ацетонилацетон, циклогександион-1,4, ацетилацетон, 4-метил-циклопентандион-1,3, 3,3-диметилпентандион-2,4 ?
№ 10.Предложите схему синтеза из ацетоуксусного эфира следующих соединений: (а) гексанона-2; (б) 3-метилпентанона-2; (в) метилпропилуксус-ной кислоты; (г) 3-фенилпропионовой кислоты. Почему кислоты лучше получать с помощью малонового, а не ацетоуксусного эфира?
Дата добавления: 2017-09-19; просмотров: 3663;
