I5. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ АЗОТА
Основными типами азотсодержащих органических соединений являются амины (N+3), соли аммония (N+4) и нитросоединения (N+5).
НИТРОСОЕДИНЕНИЯ
Определение. Нитросоединения – производные углеводородов формулы R–NO2, содержащие нитрогруппу, связанную с углеводородным радикалом. В нитросоединениях атом азота непосредственно соединен с атомом углерода, в то время как в изомерных эфирах азотистой кислоты (нитритах) азот связан с углеродом через кислородный атом:

нитросоединения эфиры азотистой кислоты
Номенклатура.За основу названия нитроалканов берется название соответствующего алкана; перед основой ставятся приставка «нитро» и цифра, показывающая положение нитрогруппы в основной цепи.
Строение нитрогруппы.В нитрогруппе обе NO-связи имеют длину – 0,122 нм (для N=O 0,115 нм, для N–O 0,136 нм). Реальное распределение электронной плотности в нитрогруппе выражается в виде гибрида двух резонансных структур:
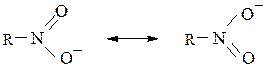
Классификация.В зависимости от природы углеводородного радикала нитросоединения бывают алифатическими (первичными, вторичными или третичными, что зависит от того, при каком атоме углерода – первичном, вторичном или третичном находится нитрогруппа) и ароматическими (нитрогруппа связана с бензольным кольцом).
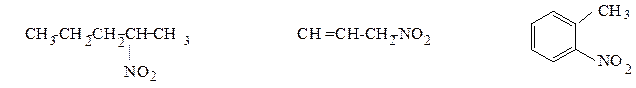
2-нитропентан (алифатическое, 3-нитропропен-1 (алифатическое, о-нитротолуол
предельное, вторичное) непредельное, первичное) (ароматическое)
Получение.Нитросоединения получают нитрованием углеводородов или реакцией нитрита серебра с алкилгалогенидами.
1) Нитрование алканов осуществляется в газовой фазе разбавленной азотной кислотой (реакция Коновалова) (110 – 140 0C).
СH3 СH3
| |
СH3–CH–CH3 + HNO3 ¾® СH3–C–CH3 + H2O
|
NO2
2-нитро-2-метилпропан
Это радикальный процесс (SR):

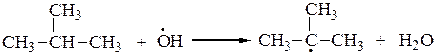
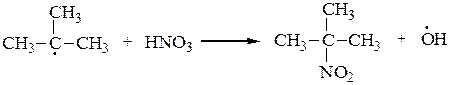
или
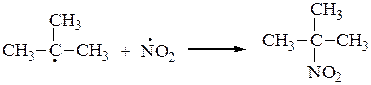
Молекула диоксида азота, образующаяся в процессе нитрования алканов, имеет неспаренный электрон, придающий ей свойства свободного радикала. Этот электрон делокализован на двух атомах кислорода и атоме азота:
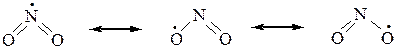
Это означает, что реакционным центром в NO2 является либо атом азота, либо один из атомов кислорода, а сама молекула обладает двойственной реакционной способностью. Поэтому молекула NO2, реагируя со свобод-ными углеводородными радикалами за счет одного из центров, образуя не только: нитросоединения, но и изомерные им эфиры азотистой кислоты (R–O–N=O).
Нитрование ароматических углеводородов по бензольному кольцу осуществляется нитрующей смесью по механизму электрофильного замещения (SЕ) и является основным методом синтеза ароматических нитросоединений.

изопропилбензол п-нитроизопропилбензол о-нитроизопропилбензол
Для введения нитрогруппы в боковую цепь ароматических углеводородов используют метод Коновалова (реакция SR):
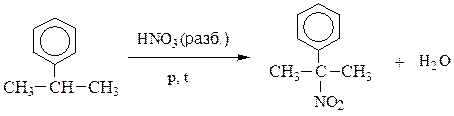
α-нитроизопропилбензол
2). Галогеналканы взаимодействуют с нитритами серебра в неполярных растворителях или щелочных металлов в сильно полярных растворителях
(CH3)2СHСН2–I + AgNO2 ¾® (CH3)2СHCH2–NO2 + AgI ↓
йодистый изобутил 1-нитро-2-метилпропан
В сольватирующих растворителях (вода, спиртах) могут образовываться также нитриты R–O–N=O (эфиры азотистой кислоты).
Физические свойства.Нитросоединения – жидкие или твердые вещества, малорастворимые в воде, растворяются в органических растворителях. Полинитросоединения окрашены в желтый или оранжевый цвета. Соединения, содержащие несколько нитрогрупп при нагревании или детонации взрываются.
Дата добавления: 2017-09-19; просмотров: 1562;
