Электропроводность расплавленных солей
Для промышленного электролиза расплавленных солей при составлении электролита подбирают возможно более электропроводящие смеси солей, так как это позволяет увеличить силу тока в электролизере, не повышая напряжения.
Большинство расплавленных солей хорошо проводят электрический ток. Имеющиеся исключения (AlCl3, SiCl4, TiCl4) обусловлены наличием гомеополярной связи.
Электропроводность расплавленных солей намного выше проводимости водных растворов (табл.14.1) и, например, для смеси KCl + TiCl3 при 800°С достигает 100 – 500 Ом-1·м-1, в то время, как удельная электропроводность водного раствора хлорида калия не превышает 30 Ом-1·м-1.
С повышением температуры расплава подвижность ионов увеличивается и возрастает проводимость, однако зависимость проводимости от температуры нелинейна и характеризуется уравнением высшего порядка:
k = k0[1 + α(t - t0) + β(t – t0)2…] (14.1)
Электропроводность смеси солей не подчиняется закону аддитивности. Она зависит от взаимодействия компонентов.
С увеличением вязкости возрастает сопротивление движению ионов в расплавах. Так как перенос тока и вязкость электролитов обусловлены движением ионов, то значения электрического сопротивления и вязкости оказываются взаимосвязанными. Для растворов известно правило Вальдена – Писаржевского о постоянстве в широком диапазоне температур произведения электропроводности на вязкость при бесконечном разбавлении раствора. В случае расплавов, при постоянной температуре:
kk·η = const, (14.2)
где η – кинематическая вязкость, а k = 1,8 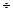 2,8 и зависит от типа соли.
2,8 и зависит от типа соли.
Таблица 14.1
Удельная электропроводность (k, Ом-1·м-1) некоторых расплавленных щелочей и солей при температуре, близкой к точке плавления
| Соединение | t,°C | k·10-2 | Соединение | t,°C | k ·10-2 |
| LiCl NaCl KCl RbCl CsCl NaF KF NaBr NaI KI AlCl3 NaNO3 KNO3 SnCl2 | 5,86 3,54 2,42 1,49 1,14 4,01 4,14 3,06 2,56 1,39 0,56·10-6 0,997 0,666 0,780 | PbCl2 BiCl3 AgCl ZnCl2 CaCl2 NaOH KOH K2SO4 LiNO3 AgNO3 CaCl2 MgCl2 Na3AlF6 | 1,478 0,406 3.910 0,0024 1,878 2,380 2,520 1,840 0,967 0,817 2,020 1,700 2,67 |
Электродное равновесие в расплавах.
На положение металла в ряду напряжений влияют ионный состав расплава и температура. В связи с отсутствием единого растворителя, который имеется в водных растворах для расплавов невозможно построить единый ряд напряжений металлов. Такие ряды можно построить для расплавов и для индивидуальных солей металлов, имеющих общий ион, или для металлов в расплавах определенного ионного состава. При переходе от одного типа анионов к другому и в зависимости от температуры в некоторых случаях изменяется положение металла в ряду напряжений. В табл. 14.2 приведены электрохимические ряды металлов в различных расплавленных средах.
Потенциалы отдельных электродов в расплавленных электролитах измеряются с помощью подбираемых для каждого расплава электродов сравнения. В качестве электродов сравнения наиболее часто применяют хлорный электрод или электроды, обратимые по отношению к ионам металлов (свинцовый, серебряный, платиновый и др.).
Так же, как и в водных растворах, кинетика электродных процессов обусловлена несколькими видами поляризации. Причины возникновения этих поляризаций и их сущность такие же, как и в водных растворах.
Особенность электролиза индивидуальной расплавленной соли при применении жидкого катода из расплавленного металла заключается в том, что концентрационная поляризация вследствие высокой подвижности ионов практически отсутствует, отсутствуют и затруднения, связанные с электрокристаллизацией. Электрохимическое перенапряжение очень мало, так как токи обмена в расплавах для всех металлов велики и составляют 5 – 33 кА/м2 (0,5 – 3,3 А/см2) (в водных растворах i0 = 10-3 – 10-7 А/см2). Поэтому отклонение потенциала от равновесного значения обычно мало (от 2 до 30 мВ).
В случае смеси солей наблюдается концентрационная поляризация, обусловленная наличием других ионов, которые могут снизить концентрацию основного иона в приэлектродном слое. В некоторых случаях отмечается предельный ток по основному иону и начало разряда более отрицательного иона соли – добавки.
Таблица 14.2
Электрохимические ряды металлов в расплавленных средах
| Растворители | Температура, °С | Электрохимические ряды |
| Индивидуальные фториды NaF – KF Na3AlF6 Индивидуальные хлориды LiCl – KCl NaCl – KCl Индивидуальные бромиды Индивидуальные иодиды | Ba, Sr, Ca, Na, K, Mg, Li, Al, Mn, Cr, Co, Ni, Fe, Cu, Ag Na, Mg, Li, Al, Mn, Zn, Cd, Ce, Pb, Co, Ni, Bi Al, Mn, Cr, Nb, W, Fe, Co, Mo, Ni, Cu, Ag Ba, Sr, K, Li, Na, Ca, La, Mg, Th, Be, Mn, Al, Zn, Cd, Pb, Sn, Ni, Co, Hg, Bi, Sb Li, La, Ce, Mg, Th, Mn, U, Zr, Al, Be, Ta, Tl, Zn, W, Cd, Mo, V, Co, Ni, Ag, Sb, Bi, Cu, Pd, Pt Mg, Th, U, Mn, Al, Zr, Ti, Zn, Cr, Fe, Pb, Sn, Co, Cu, Ni, Ag, Pb, Pt, Au Ba, K, Sr, Li, Na, Ca, Mg, Mn, Fe, Al, Zn, Cd, Pb, Sn, Ag, Cu, Co, Hg, Bi, Sb Na, Mg, Mn, Zn, Cd, Al, Ag, Sn, Pb, Cu, Bi, Hg, Co, Sb |
Дата добавления: 2017-01-29; просмотров: 2836;
