Лекция 6 Топливные элементы.
В отличие от первичных ХИТ, в которых запас активных веществ содержится в электродах, в ТЭ электрическая энергия образуется за счет окислительно-восстановительных реакций на электродах, к которым активные вещества – топливо и окислитель – непрерывно подаются извне. Принципиальная схема устройства ТЭ, в котором используется электрохимическая система  топливо│электролит│окислитель Å, ясна из рис. 6.1.
топливо│электролит│окислитель Å, ясна из рис. 6.1.

Рис. 6.1 Принципиальная схема устройства топливного элемента (ТЭ)
Батарея ТЭ в совокупности со вспомогательными системами, обеспечивающими ее работу, образуют электрохимический генератор (ЭХГ). В систему ЭХГ (рис. 6.2) входят оборудование и устройства, обеспечивающие хранение реагентов (СХР), их подвод к ТЭ (ПР), отвод продуктов реакции (ОП) и теплоты (ОТ), различные контрольно-регулирующие функции (КР), в том числе регулирование генерируемого в ТЭ электрического тока (РТ), регулирование температуры и т.п.

Рис. 6.2 Схема электрохимического генератора
В 1894 г. В.Оствальдом была показана принципиальная возможность непосредственного превращения химической энергии топлива в электрическую энергию с высоким коэффициентом полезного действия (η). Из термодинамического уравнения – zFE = DH – TDS следует, что в электрохимической системе
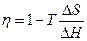 (S – энтропия, H – энтальпия).
(S – энтропия, H – энтальпия).
Так как DH < 0, то η > 1, если DS > 0, т.е. в тех случаях, когда в результате реакции образуется большее количество молей газа, чем их вступило в реакцию (например, при реакции С + О2 = 2СО). При этом в электрическую энергию должна превращаться теплота окружающей среды (DQ = ТDS). Однако проведенные впоследствии исследования показали невозможность получения высоких КПД при «электрохимическом сжигании» природного топлива. Новый импульс к развитию ТЭ был дан в начале 60-х годов XX века работами по созданию ТЭ с конвертированным топливом. В настоящее время созданы ТЭ с η ≈ 75%.
В качестве топлива в ТЭ могут быть использованы как газообразные (Н2, СО, СО + Н2), так и жидкие (гидразин, спирты, альдегиды) и твердые (Li, Na, Zn) восстановители, в качестве окислителей соответственно могут применяться О2, Cl2, N2O3, HNO3, пероксидные соединения.
Электролитами служат растворы кислот и щелочей, солевые растворы. Большое распространение получили так называемые матричные электролиты – пропитанные соответствующим раствором пористые или волокнистые (например асбестовые) мембраны, а также ионообменные смолы. Учитывая большую стойкость конструкционных материалов в щелочах, щелочным электролитам часто дается предпочтение перед кислотными.
Одним из наиболее распространенных является водородно-кислородный (воздушный) топливный элемент с угольными электродами. Токообразующая реакция на катоде может быть представлена следующим образом:
O2(адс.) + H2O + 2 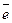 =
=  + OH- (6.а)
+ OH- (6.а)
При потенциале обесточенного электрода 1,10 – 1,13В относительно водородного электрода. В качестве материала катода используются углеродные материалы, на которые наносится специальный слой катализатора, обеспечивающий ускорение реакции (6.а).
Токообразующая реакция на аноде связана с окислением топлива (в данном случае водорода):
H2(газ) ® 2H(адсорбирован на катализаторе),
2H(адс.) + OH- ® 2H2O + 2 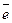 (6.б)
(6.б)
Очевидно, вследствие того, что потенциал водородного электрода равен нулю, напряжение разомкнутой цепи должно быть равно потенциалу кислородного электрода, т.е. ~1,1В (под нагрузкой эта величина снижается до 0,7 – 0,8В).
Из уравнения (6.б) следует, что продуктом «сгорания» топлива в топливном элементе является вода. Таким образом, это самый экологически чистый вид получения электроэнергии, которому в связи с этим принадлежит будущее.
Токообразующие реакции в ТЭ с газообразным топливом (H2) и окислителем (O2) не могут идти с достаточной скоростью без применения активных электродов особой конструкции (пористые, прессованные), содержащих катализаторы. Основой таких электродов являются углеродные материалы, никель Ренея и карбонильный никель, металлические черни и другие материалы, в том числе металлокерамические. Высокоразвитая поверхность пористых электродов снижает их поляризацию. В качестве катализаторов на катодах используют платину, палладий, скелетное серебро, шпинели (например CoO∙Al2O3 на угле), а на анодах – платину, палладированную платину (в количествах ~10 г/м2), скелетный никель (никель Ренея).
Проблемы создания трехфазного равновесия электрод-газ-электролит в газожидкостных электродах решаются на основе законов капиллярного равновесия. Кинетика электрохимических реакций на таких электродах имеет ряд особенностей.
Для создания электрохимически стабильной во времени трехфазной границы применяют монодисперсные порошки, для предотвращения замокания пор используют гидрофобизаторы.
Для облегчения доступа газа, мало растворимого в электролите, к электроду на нем должна быть создана тонкая пленка электролита (мениск жидкости) оптимальной протяженности lопт (рис. 6.3), отвечающей максимальному токосъему с данного электролита Iр. Как видно из рис. 6.3, при дальнейшем увеличении l рабочий ток практически не будет изменяться. Все эти факторы учитывают при выборе зернистости порошка, условий его прессования, дальнейшей обработки электродов.
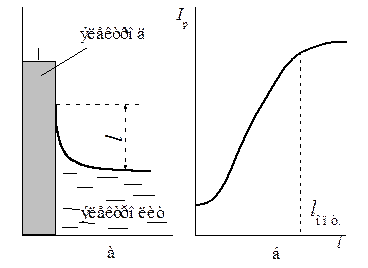
Рис. 6.3 Зависимость токосъема электрода от протяженности пленки электролита
Различают гидрофильные и гидрофобные газожидкостные прессованные электроды. В монослойных (в том числе двухскелетных) газодиффузионных электродах ассимилируется всего ≈ 15% активного газообразного вещества, остальной газ перед возвращением в электрод должен быть подвергнут дополнительной очистке во избежание отравления катализаторов. В двухслойных (вентильных) гидрофильных электродах помимо крупнопористого рабочего слоя, обращенного к газу, имеется мелкозернистый запорный слой, который затапливается электролитом и способствует, таким образом, полному использованию газообразного активного вещества и созданию оптимального мениска раствора электролита в рабочей зоне. Зернистость электродного материала в этих слоях подбирается таким образом, чтобы давление, под которым газ подается к электроду (Рr), было больше давления газа в рабочем слое (Р2) и меньше давления газа в запорном слое (Р1):Р1 > Рr > Р2.
Активные пористые электроды готовят спеканием при 700°С в атмосфере водорода раздробленной, спрессованной при 4000 кг/см2 смеси двух массовых частей карбонильного никеля с одной массовой частью никеля Ренея (сплав Ni : Al = 1:1). После обработки спеченного сплава щелочью, которая растворяет алюминий, получают каталитически активные электроды с сильно разупорядоченной никелевой решеткой. Электроды пирофорны, поэтому их до употребления хранят под водой.
Топливные элементы принято классифицировать по рабочим температурам: различают низкотемпературные (до 150°С), среднетемпературные (150 – 300°С) и высокотемпературные (до 1000°С) ТЭ. Отдельно можно выделить ТЭ регенеративного типа, в которых можно регенерировать использованные активные вещества. Ниже приводятся принципиальные схемы и общие характеристики ТЭ каждого класса.
Низкотемпературные ТЭ с твердым электролитоносителем (рис. 6.4) имеют малый объем и массу, малое межэлектродное пространство (толщина мембраны), что позволяет собирать батареи фильтпрессного типа.

Рис. 6.4 Низкотемпературный ТЭ с твердым электроносителем
Применение в кислородно-водородном ТЭ катионитной мембраны, являющейся одновременно сепаратором, на которую напрессовывают, либо напыляют на тефлоновом связующем скелетные никелевые электроды, исключает необходимость использования двухслойных электродов. Работают эти ТЭ при комнатной температуре и атмосферном давлении, Uр = 1,08 В, КПД η = 60%, срок службы 1 год. Батареи развивают среднюю мощность 30 Вт, пиковую – 150 – 220 Вт и используются в паре с НК аккумуляторами на космических аппаратах, биосателлитах, в радарных установках, приборах ночного видения, сигнальных устройствах.
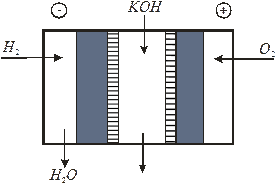
Рис. 6.5 Среднетемпературные топливные элементы
Среднетемпературные ТЭ (элементы Бэкона, рис. 6.5) работают при 200 – 250°С, электроды – двухслойные, изготовленные из никеля, с платиновыми (на отрицательном электроде) и палладиевыми (на положительном электроде) катализаторами. Поэтому топливо (Н2) и окислитель (О2) подвергают тщательной очистке. В элементе используется 75 - 85% КОН при давлении до 4 атм. Собирают батареи фильтпрессного типа с межэлектродным зазором 1,6 мм, толщина элемента 3,9 мм. Плотность разрядного тока 0,02 – 0,3 А/см2, максимальная мощность 2,3 кВт, η = 60%. Использовались ТЭ в пилотируемых космических кораблях программ «Джемини» и «Аполлон» (США). Продукт токобразующей реакции – вода – применялась для питьевых и других бытовых нужд. В настоящее время ресурс усовершенствованных среднетемпературных ТЭ, применяемых в военной и специальной технике, доведен до 4 - 5 тысяч часов.
Высокотемпературные ТЭ имеют ряд преимуществ пред ТЭ, рассмотренными нами выше. За счет снижения поляризации и омических потерь в электролите повышаются энергетические параметры ТЭ; уменьшается опасность отравления катализаторов (их используют очень мало); электроды работают более стабильно. Теплота реакции в ТЭ выделяется при высокой температуре, т.е. является высокопотенциальной и может быть использована либо в тепловых машинах для выработки дополнительной электроэнергии, либо для проведения реакции (эндотермической) конверсии углеводородного топлива. Это повышает экономическую эффективность ТЭ, в котором 30 – 40% энергии превращается в теплоту.
Различают высокотемпературные элементы, в которых в качестве электродов используют расплавленные нитраты (их можно было бы отнести к среднетемпературным ТЭ, так как температуры достигают 200°С), расплавленные карбонаты (рабочие температуры 550 – 700°С) и твердые электролиты, загущенные алюмосиликатами (рабочие температуры 850 – 1000°С). Так, например, для реализации электрохимической системы  H2(Pt)
H2(Pt) 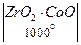 (Pt)O2Å фирма “Вестингауз” (США) предложила так называемые наперстковые батареи (рис. 6.6), состоящие из 20 кислородно-водородных элементов. На прессованные твердые керамические “наперстки” - электролиты (толщиной 0,1 – 0,4 мм) методом плазменного напыления наносят электродные материалы: платину, либо металлы группы железа и оксидные композиции, обладающие полупроводниковыми свойствами (оксиды церия и лантана), - в качестве анодов и платину, либо полупроводниковые оксиды серебра или циркония – в качестве катодов. Такие ТЭ считают перспективными; в них исключается утечка электролита и его корродирующее воздействие на аппаратуру. Высокотемпературные ТЭ используют только в стационарных установках большой мощности, работающих длительное время.
(Pt)O2Å фирма “Вестингауз” (США) предложила так называемые наперстковые батареи (рис. 6.6), состоящие из 20 кислородно-водородных элементов. На прессованные твердые керамические “наперстки” - электролиты (толщиной 0,1 – 0,4 мм) методом плазменного напыления наносят электродные материалы: платину, либо металлы группы железа и оксидные композиции, обладающие полупроводниковыми свойствами (оксиды церия и лантана), - в качестве анодов и платину, либо полупроводниковые оксиды серебра или циркония – в качестве катодов. Такие ТЭ считают перспективными; в них исключается утечка электролита и его корродирующее воздействие на аппаратуру. Высокотемпературные ТЭ используют только в стационарных установках большой мощности, работающих длительное время.
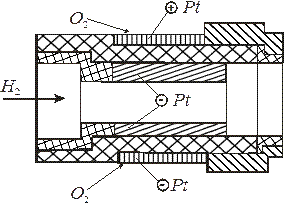
Рис. 6.6 Высокотемпературные ТЭ
Примером высокотемпературного ТЭ регенерирующего типа может быть ТЭ системы  Li
Li 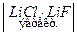 H2 Å, E = 0,725 B, токообразующая реакция:
H2 Å, E = 0,725 B, токообразующая реакция:
2Li + H2 = 2LiH
При 850°С происходит разложение гидрида лития с образованием исходных активных веществ – топлива (Li) и окислителя (Н2). Повышение температуры до 850°С осуществляется при помощи радиоактивного изотопа Се144 (радиохимическая регенерация). Эти элементы используют в космических аппаратах. Помимо радиохимической, тепловой регенерации может быть применена также электрохимическая регенерация (электролизом), либо световая или химическая регенерация.
К преимуществам ТЭ следует отнести возможность получения высоких КПД и удельных энергий, устойчивость работы при недогрузках, большой ресурс ТЭ; бесшумность в работе, возможность регенерации и утилизации продуктов реакции, экологическую чистоту и уникальные области применения этих ХИТ. Они перспективны для автомобильного транспорта и в малой энергетике.
Дальнейшее развитие ТЭ сдерживается высокой стоимостью программ по их разработке, а также невозможностью эффективного использования в ТЭ природного топлива. Применение ТЭ ограничивается в настоящее время главным образом космической и военной техникой, но совершенно очевидна перспективность их использования в будущем.
Дата добавления: 2017-01-29; просмотров: 1378;
