Производство водорода и кислорода
Водород является ценным сырьем, которое находит широкое и разнообразное применение. Большое количество водорода применяется как сырье для ряда важных процессов химической промышленности: синтез аммиака, бензола. В металлургии водород используется для селективного восстановления цветных металлов из аммиачных растворов и для восстановления руд. Водород применяют для создания необходимой атмосферы в печах, для резки и сварки металлов и т.д.
Промышленные способы получения водорода подразделяются на физические, химические и электрохимические.
Физические методы основаны на фракционном выделении водорода из содержащей водород газовой смеси путем изменения физического состояния смеси (например, метод глубокого охлаждения коксового газа с конверсией всех компонентов, кроме водорода). Химические методы основаны на термическом разложении углеводородов или на процессах конверсии углеродов и окиси углерода, например:
СН4 + Н2О → СО + 3Н2; СО + Н2О → СО2 + Н2
и на восстановлении паров воды, например:
4Н2О + 3Fe → Fe3О4 + 4Н2
Электрохимический способ получения водорода основан на электролитическом разложении воды. На долю электрохимических методов приходится примерно 3% получаемого в мире водорода, однако по существующим оценкам, доля электролитического водорода, получаемого электрохимическим методом, будет увеличиваться в связи с сокращением запасов природных газов и нефти. В последние годы широко обсуждается перспектива использования водорода в качестве топлива, при сжигании которого в топливных элементах практически не образуется экологически вредных веществ.
Чистую воду подвергать электролизу нецелесообразно вследствие ее малой удельной проводимости (4∙10-6См/м для дистиллированной воды и 1∙10-1 См/м – для водопроводной). Электролиз воды ведется с добавками кислоты, щелочи, либо соли для повышения электропроводности электролита и снижения расхода электроэнергии. Электропроводность растворов серной кислоты выше, чем растворов щелочи, однако, в промышленности применяют щелочные растворы, т.к. в них обычные конструкционные материалы являются устойчивыми.
Основные электродные процессы при электролизе – выделение водорода на катоде и кислорода на аноде по суммарной реакции 2Н2О → 2Н2 + О2. Кислород является при электролизе попутным продуктом, самостоятельного значения этот продукт не имеет, поскольку получать кислород из воздуха экономичнее. Основы реакции в щелочной среде:
на катоде 2Н2О + 2  → Н2 + 2ОН- (7.а)
→ Н2 + 2ОН- (7.а)
на аноде 4ОН- → 4Н2О + 2О2 + 4  ; (7.б)
; (7.б)
в кислой среде:
на катоде 2Н+ +  → Н2 (7.в)
→ Н2 (7.в)
на аноде 2Н2О → 4Н+ + О2 (7.г)
В щелочном электролите нет катионов, которые могли бы разряжаться на катоде и приводить к появлению других электродных реакций, кроме реакции образования газообразного водорода.
Единственной побочной реакцией при значительно более положительных потенциалах, чем реакция катодного образования водорода является реакция электровосстановления растворенного кислорода
О2 + 2Н2О + 4  → 4ОН- (7.д)
→ 4ОН- (7.д)
Однако ее скорость ограничена малой растворимостью кислорода в щелочных растворах, особенно при больших температурах. Тратится лишь доля процента тока. Поэтому электролизные ванны все работают с очень высокими катодными выходами по току (порядка 97-98% с учетом утечек тока).
Процесс выделения кислорода на аноде сопровождается окислением материала анода с образованием поверхностных окислов типа МеО. Поэтому при длительном электролизе разряд анионов идет не на металле, а на окисленной поверхности. С течением времени перенапряжение выделения кислорода несколько повышается, пока не достигнет через длительный промежуток времени постоянного значения. Поэтому величина анодного потенциала в промышленной, длительно работающей ванне, более положительна, чем та, которую определяют в лабораторных условиях.
Электродные материалы. К материалам для электродов предъявляется требование – перенапряжение выделения водорода и кислорода на них должно быть по возможности мало. Выбор материалов электродов диктуется необходимостью снижения непроизводительного расхода электроэнергии на поляризацию электродов.
Как видно на рис. 7.1 наилучшим катодным материалом является платинированная платина, однако из-за высокой стоимости и нестойкости губчатого слоя платину в качестве электродного материала применять нельзя.

Рис.7.1 Поляризационные кривые выделения водорода на некоторых металлах из раствора NaОН (16 вес.%): ¾ при 25°С; - - - при 80°С.
Металлы группы железа устойчивы в щелочных растворах, обладают невысоким перенапряжением и пригодны в качестве материалов для катодов. Перенапряжение на железе и кобальте на несколько десятков милливольт меньше, чем на никеле. Другие металлы (Ti, Pb) характеризуются более высокими значениями перенапряжения на них водорода и на практике не применяются.
На рис. 7.2 приведены анодные поляризационные кривые выделения кислорода из щелочного раствора, из которых следует, что на металлах группы железа перенапряжение выделения кислорода также невелико. Следовательно, эта группа металлов вполне пригодна в качестве материалов не только для катодов, но и для анодов.
Для изготовления катодов используется обычная сталь. Катод иногда активируют путем осаждения на его поверхность никеля, содержащего серу, или металлов платиновой группы.
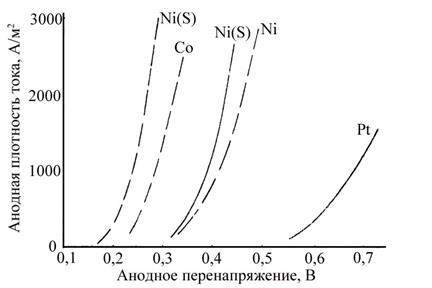
Рис.7.2 Поляризационные кривые выделения кислорода на некоторых металлах из раствора NaОН (16 вес.%) (Ni(S) – содержащее серу никелевое покрытие):¾ при 25°С;- - - при 80°С
В качестве анодов при электролизе водных щелочных растворов используют углеродистую сталь, на которую электрохимически наносят никелевое покрытие толщиной 100 мкм. Такой анод сохраняет достаточную коррозионную устойчивость в щелочных растворах даже при наличии 1,5∙103 пор на 1 м2. Малый износ такого анода даже при большей пористости гальванического покрытия объясняется забиванием пор продуктами коррозии стальной основы. Никелирование анода переводит его в пассивное состояние и делает нерастворимым в области потенциалов, при которых происходит выделение кислорода.
Во всех промышленных ваннах для разделения газов применяют диафрагмы, которые изготавливают из асбестовой ткани. Роль диафрагмы – воспрепятствовать смешению газов. Механическую прочность асбестовой ткани усиливают путем включения в пряжу никелевых проволок.
Состав раствора. Выбор состава и концентрации электролита, а также конструкция ванны и режимы ее эксплуатации диктуются целевым назначением электролизера и обусловлены необходимостью максимального снижения непроизводительного расхода электроэнергии на омические потери в электролите и контактах. В качестве электролита для электролиза воды применяют растворы едкого кали и растворы едкого натра. В электролит вводят 2 – 3 г/л К2Сr2О7 для подавления коррозии стали. Пригодной для электролизера считается вода с удельной электрической проводимостью не выше 10-3 См∙м-1, содержащая не более 10 мг/л хлоридов и до 3 мг/л железа. Однако для питания электролизеров рекомендуется применять более чистую воду; проводимость не выше 10-4 См∙м-1, содержание железа не выше 1 мг/л, хлоридов 2 мг/л и сухого остатка 3 мг/л.
В процессе электролиза происходит накопление в электролите примесей – карбонатов, хлоридов, сульфатов, силикатов, а также железа, образующихся в результате разрушения деталей электролизера и диафрагмы. Посторонние анионы, накапливающиеся в растворе, не участвуют в электрохимических реакциях, за исключением ионов хлора, которые могут вызвать депассивацию анода.
Ионы железа, присутствующие в электролите, разряжаются на катоде с образованием железной губки. Толщина губки в процессе электролиза увеличивается, слой ее достигает диафрагмы, вызывая ее металлизацию, вследствие чего на анодной стороне начинает выделяться водород. Установлено, что при введении в раствор хромата калия или натрия электроосаждение железа на катоде уменьшается. На катоде образуется пленка из продуктов неполного восстановления хроматов, затрудняется электровосстановление соединений железа.
Основной примесью в водороде является кислород, в кислороде – водород. Содержание щелочи в водороде обычно до 20 мг/м3, в кислороде до 100 мг/м3. Электролитический водород должен иметь следующий состав: не менее 99,7% (об.) водорода, не более 0,3%(об.) кислорода. Электролитический кислород должен содержать не более 0,7% (об.) водорода.
Очистку газов от щелочного тумана осуществляют в насадочных фильтрах, заполненных стеклянной ватой. Очистку водорода от примеси кислорода приводят в контактных аппаратах на никель-алюминиевом и никель-хромовом катализаторах при 100 - 130 °С. Очистка кислорода от водорода происходит на катализаторах: платинированном асбесте, платине, нанесенной на оксид алюминия. После охлаждения газы осушаются сорбентами (силикагель, амомогель).
Для выбора оптимальной концентрации щелочи необходимо знать зависимость удельной электропроводности растворов от концентрации при различных температурах. Кривые, выражающие эту зависимость, при всех температурах проходят через максимум (рис. 7.3).


Рис.7.3. Зависимость удельной электропроводности растворов NаОН (а) и КОН (б) от концентрации при различных температурах
Максимальная электропроводность растворов КОН больше, чем NаОН, но стоимость гидроксида натрия меньше. Поэтому, как КОН, так и NаОН одинаково могут быть использованы в электролизных ваннах. В промышленных ваннах максимальной электропроводностью обладают 21% раствор NаОН и соответственно 32% КОН. На практике применяют 16 – 20% раствор NаОН и 25 – 30% раствор КОН.
Температура. Электролиз водных растворов щелочей проводится при повышенных температурах с целью снижения перенапряжения выделения газов и удельного сопротивления электролита. На рис. 7.4 представлена зависимость между температурой, удельным сопротивлением и оптимальной концентрацией растворов щелочей.
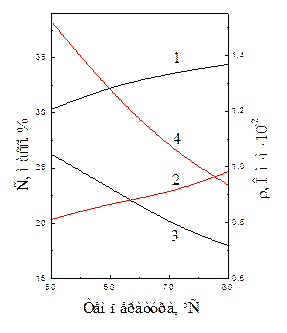
Рис. 7.4 Зависимость оптимальной концентрации (1, 2) и удельного сопротивления (3, 4) растворов КОН (1, 3) и NаОН (2, 4) от температуры.
Показатели процесса электролиза (Uр) Напряжение на клеммах электролизера состоит из напряжения разложения воды Епр – разности равновесных потенциалов кислорода  и водорода
и водорода 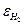 (Епр =
(Епр =  -
- 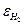 ), перенапряжения водорода и кислорода
), перенапряжения водорода и кислорода  и
и 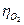 на данных электродах и сумм омических потерь ΣIRОм, главные из которых – падение напряжения в электролите IRЭл + IRгаз, в диафрагме IRдиафр. и в электродах и контактах IRОм, В:
на данных электродах и сумм омических потерь ΣIRОм, главные из которых – падение напряжения в электролите IRЭл + IRгаз, в диафрагме IRдиафр. и в электродах и контактах IRОм, В:
Up= Епр +  +
+ 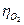 +I(Rэл.+Rгаз+Rконт.), (7.1)
+I(Rэл.+Rгаз+Rконт.), (7.1)
где I – рабочий ток на электролизере, А.
Перенапряжение водорода (кислорода) при данной рабочей плотности тока можно определить по уравнению Тафеля η = а + blgi, воспользовавшись справочными значениями коэффициентов а и b, соответствующих материалу электрода и раствору электролита.
Падение напряжения в электролите рассчитывают из площади электродов S, расстояния между ними l и удельной электропроводности электролита k, значение которой можно взять из справочника (учитывая температуры электролита во время опыта).
Увеличение падения напряжения за счет газовыделения составляет примерно 10% падения напряжения в электролите. Падение напряжения в электродах и контактах принимают равным 0,1 – 0,5В.
Примерный баланс напряжения фильтпресной биполярной ванны, имеющей межэлектродное расстояние 3,6 см и работающей при давлении до 100 атм. с плотностью тока около 1000 А/дм2, приведено в таблице 7.1.
Таблица 7.1
Баланс напряжений фильтпрессной биполярной ванны
| Составляющие баланс напряжения | Величина составляющих, В | Распределение напряжения на ванне, % |
| Напряжение разложения при давлении газов 10 атм. и при 80°С Катодная поляризация Анодная поляризация Падение напряжения в электролите (с учетом газонаполнения при 10 атм.) Падение напряжения в диафрагме Падение напряжения в проводниках первого рода | 1,24 0,20 0,22 0,50 0,10 0,05 | |
| Итого | 2,33 |
Электродные плотности тока. Значение электродных плотностей тока при электролитическом разложении воды колеблется в широких пределах в зависимости от конструкции электролизера. Успехи в области создания конструкций электролизеров с электродами, обеспечивающими быстрый отвод газов и снижение газонаполнения, активирование поверхности электродов, повышение температуры электролита и снижение вследствие этого перенапряжения газов позволили в новых конструкциях промышленных электролизеров повысить плотности тока до 2,5 - 3,7 кА/м2 (0,25 – 0,37 А/см2)
Конструкции электролизеров. Все современные конструкции электролизеров относятся к фильтр-прессному типу с биполярным включением электродов. Схема фильтрпрессного биполярного электролизера для получения водорода и кислорода представлена на рис. 7.5

Рис. 7.5. Биполярный фильтр-прессный электролизер: 1 – выносной электрод; 2 – монополярный электрод – анод; 3 – биполярный электрод; 4 – монополярный электрод – катод; 5 – диафрагма; 6 – стяжная плита; 7 – стяжной болт; 8 – диафрагменная рама.
Фильтр-прессные биполярные электролизеры могут иметь эквивалентную нагрузку до 1200 – 1800 кА и состоять из 160 – 170 отдельных ячеек.
Дата добавления: 2017-01-29; просмотров: 1686;
