Теоретические основы электролиза растворов хлоридов
Получение хлора и щелочи основано на электролизе водных растворов хлоридов щелочных металлов двумя методами: с твердым катодом (диафрагменный) и с ртутным катодом.
На аноде во всех способах электрохимических производств хлора могут протекать две электрохимические реакции – выделение хлора и кислорода:
2Cl- - 2 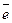 →Cl2 (8.б)
→Cl2 (8.б)
2H2O – 4 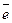 → O2 + 4H+ (8.в)
→ O2 + 4H+ (8.в)
Выход хлора по току определяется соотношением долей тока, расходуемых на выделение хлора и кислорода. По закону Фарадея при прохождении 1 А/ч электричества при электролизе выделится 1, 232 г хлора, 1,492г гидроксида натрия и 0,0376 г водорода. Вследствие протекания побочных электрохимических реакций на электродах и химических реакций в объеме раствора выход по току продуктов реакции всегда меньше 100%.
Обратимый потенциал разряда ионов хлора в растворе с содержанием 4,53 моль/л NaCl, при температуре 25°С равен 1,325 В; обратимый потенциал выделения кислорода в результате окисления молекул воды, рассчитанный по уравнению Нериста, при 25°С равен 1,23 В. Следовательно, хлор на аноде выделяется при электролизе водных растворов хлоридов за счет более высокого перенапряжения выделения кислорода.
На твердых катодах при электролизе растворов хлоридов щелочных металлов протекает реакция выделения водорода и образуется щелочь по реакции:
2Н2О + 2 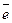 → 2ОН- + Н2 (8.г)
→ 2ОН- + Н2 (8.г)
С целью снижения перенапряжения на электролизере стремятся уменьшить потенциал выделения водорода. В качестве твердого электрода обычно используют сталь. Потенциал выделения водорода зависит от состояния поверхности катода, плотности тока, температуры и состава раствора.
Обратимый потенциал выделения водорода в растворе, содержащем хлорид натрия и едкий натр при соотношении, реально существующем в условиях электрохимического производства, составляет – 0,845В (отн. н.в.э). Перенапряжение водорода на стальном катоде при электролизе растворов хлорида с твердым катодом составляет 0,3В. Перспективным, вероятно, является снижение потенциала в результате деполяризации катода кислородом. При подаче к поверхности катода кислорода или воздуха протекает реакция:
О2 + 2Н2О + 4 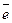 → 4ОН- , (8.д)
→ 4ОН- , (8.д)
которой соответствует потенциал, более положительный, чем потенциал выделения водорода. При использовании пористого графитового катода, подвергнутого предварительной гидрофобизации путем пропитки полимерным соединением, потенциал катода может быть снижен до 0,3 – 0,4В.
Суммарный процесс разложения хлорида натрия выражается следующим химическим уравнением:
2Н2О + 2 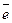 → Н2 + 2ОН-
→ Н2 + 2ОН-
|
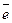
 2H2O + 2Cl- → Cl2 + H2 + 2OH-
2H2O + 2Cl- → Cl2 + H2 + 2OH-
или 2H2O + 2NaCl → Cl2 + H2 + 2NaOH
Напряжение разложения в стандартных условиях для этой реакции составляет 2,17В и теоретический расход энергии на 1 т хлора 1640 кв/ч.
Выход по току зависит от степени совершенства разделения катодных и анодных продуктов и от растворимости хлора в анолите. Растворимость хлора в растворе хлорида натрия уменьшается с ростом температуры и концентрации NaCl. Следовательно, побочные реакции, в основе которых лежит растворенный хлор, будут уменьшаться с увеличением концентрации хлорида натрия и температуры.
Дата добавления: 2017-01-29; просмотров: 1876;
