Лекция 11 Теория замедленного разряда.
Стадия массопереноса присуща любым гетерогенным реакциям, но в электрохимических процессах происходит еще и переход заряженных частиц через границу раздела. Если эта стадия является лимитирующей, то соответствующее этому процессу перенапряжение называется перенапряжением перехода (перенапряжение разряда - ионизации). В этом случае замедленной является собственно электрохимическая стадия.
Долгое время считалось, что скорость переноса заряда (электрона) не может быть замедленной, поскольку ее скорость всегда существенно выше, чем скорость любой другой стадии всего процесса. Только в 1930г. М.Фольмер (Германия) и Т.Эрдей - Груз (Венгрия) сформулировали теорию замедленного разряда, позволяющую объяснить такую возможность. В 1933г. эта теория была усовершенствована А.Н.Фрумкиным, который учёл влияние электрического поля двойного слоя на перенос заряженных частиц.
Рассмотрим электрохимическую реакцию восстановления:
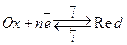 (11.а)
(11.а)
Общий ток (плотность тока, скорость реакции) будет определяться уравнением (11.1)

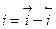 (11.1)
(11.1)
При равновесном потенциале 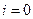 , следовательно:
, следовательно:
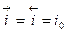 (11.2)
(11.2)
Этот ток (плотность тока) 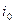 носит название тока обмена (точнее, плотности тока обмена). Это одна из важнейших характеристик электрохимической реакции. Чем выше плотность тока обмена, тем с большей скоростью происходит как прямая реакция (восстановление) так и обратная (окисление), т.е. быстро восстанавливается равновесие. Реакции с высокими плотностями тока обмена называются обратимыми в отличие от реакции с низкими плотностями тока обмена, которые называются необратимыми.
носит название тока обмена (точнее, плотности тока обмена). Это одна из важнейших характеристик электрохимической реакции. Чем выше плотность тока обмена, тем с большей скоростью происходит как прямая реакция (восстановление) так и обратная (окисление), т.е. быстро восстанавливается равновесие. Реакции с высокими плотностями тока обмена называются обратимыми в отличие от реакции с низкими плотностями тока обмена, которые называются необратимыми.
При лимитирующей стадии разряда – ионизации (реакция 11.а) нарушается само электродное равновесие и уравнение Нернста, которое справедливо для равновесных процессов, не может быть использовано для расчёта электродных потенциалов.
М.Фольмер и Т.Эрдей – Груз показали, что в этом случае величина плотности тока (скорости реакции) определяется следующим соотношением:
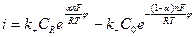 , (11.3)
, (11.3)
где 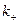 и
и 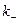 - константы скорости прямой и обратной реакции, соответственно катодной (восстановления) и анодной (окисления),
- константы скорости прямой и обратной реакции, соответственно катодной (восстановления) и анодной (окисления), 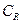 и
и 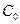 - концентрации восстановленной формы и окисленной формы,
- концентрации восстановленной формы и окисленной формы, 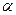 - коэффициент переноса.
- коэффициент переноса.
Для обычных реакций 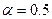 , однако, этот коэффициент зависит от перенапряжения и при высоких или низких значениях этого параметра он может принимать значения от 0 до 1. Учитывая, что в состоянии равновесия:
, однако, этот коэффициент зависит от перенапряжения и при высоких или низких значениях этого параметра он может принимать значения от 0 до 1. Учитывая, что в состоянии равновесия:
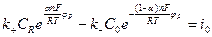 (11.4)
(11.4)
и, что:
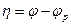
 (11.5)
(11.5)
получим из (11.3):
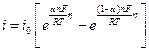 (11.6)
(11.6)
Из уравнения (11.6) следует, что скорость электрохимической реакции прямо пропорциональна плотности тока обмена и разнице двух экспоненциальных членов, содержащих перенапряжение. То есть, скорость электрохимической реакции определяется: плотностью тока обмена, перенапряжением и коэффициентом переноса. Соотношение (11.6) справедливо, если 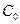 и
и 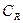 не зависят от плотности тока или потенциала, т.е. в отсутствие замедленности стадии массопереноса.
не зависят от плотности тока или потенциала, т.е. в отсутствие замедленности стадии массопереноса.
Дата добавления: 2017-01-29; просмотров: 1632;
