Лекция 7. Методы расчета равновесных потенциалов. Относительная шкала электродных потенциалов
Потенциал ионно - металлического электрода. Относительная шкала электродных потенциалов. Равновесный потенциал окислительно-восстановительных систем. Мембранный потенциал и стеклянный электрод. Методы измерения pH растворов. Ион - селективные электроды.
На предыдущих лекциях был рассмотрен вопрос о равновесном потенциале, т.е. таком потенциале, при котором электрод находится в равновесии с ионами того металла, из которого он состоит.
При равновесном потенциале одновременно осуществляются два условия:
1. На фазовой границе отсутствуют электрохимические или химические превращения, т.е. отсутствует ток во внешней цепи.
2. Потенциал самопроизвольно приходит к одной и той же величине как от более высоких, так и от более низких его значений.
Это динамическое равновесие, при котором скорость прямой реакции (например, растворение металла) равна скорости обратной реакции (осаждение его из раствора).
Me  Men+ +ne (7.а)
Men+ +ne (7.а)
Такому состоянию соответствует определённая величина потенциала на границе электрод - раствор. Такой потенциал называется равновесным, поскольку он соответствует состоянию равновесия.
Рассмотрим общую реакцию ячейки, частным случаем которой является реакция (7.а):
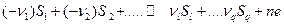 (7.б)
(7.б)
В.Нернстом было показано, что равновесный потенциал для реакции (7.б) может быть рассчитан из следующего уравнения:
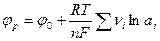 , (7.1)
, (7.1)
где R –универсальная газовая постоянная; F -константа Фарадея; n -число электронов, перенесённых в электрохимической реакции T –абсолютная температура; 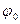 - носит название стандартного электродного потенциала.
- носит название стандартного электродного потенциала.
Из уравнения (7.1) следует, что стандартный электродный потенциал – это такой потенциал, который достигается при условии, что:
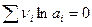
Величина 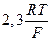 является постоянной величиной при постоянной температуре. Она равна 59 mB при 25°C.
является постоянной величиной при постоянной температуре. Она равна 59 mB при 25°C.
Абсолютный скачок потенциала на границе раствора определить нельзя, поэтому для измерения равновесных потенциалов используют относительные измерения, а в качестве стандартного используется водородный электрод. Его описание будет дано ниже. Стандартный потенциал водородного электрода 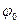 принят за “0”. Все остальные стандартные потенциалы сведены в таблицы.
принят за “0”. Все остальные стандартные потенциалы сведены в таблицы.
Классификацию электродов можно проводить по окислительно-восстановительной природе веществ, участвующих в электродном процессе.
Дата добавления: 2017-01-29; просмотров: 2036;
