Электроды первого рода. Потенциал ионно-металлического электрода.
Электродом первого рода называют систему, в которой восстановленной формой является металл электрода, а окисленной – простые или комплексные ионы этого же металла.
Рассмотрим, например, систему:
 электрод сравнения
электрод сравнения
В этой системе будет протекать реакция, которую в общем виде можно передать уравнением (7.а). Применим уравнение (7.1) к этой реакции:
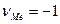 ;
; 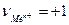
тогда:
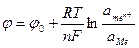 (7.2)
(7.2)
Поскольку активность металла равна 1, из (7.2) получим:
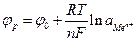 (7.3)
(7.3)
Уравнение (7.3) позволяет рассчитать равновесный потенциал ионно – металлического электрода. В таблице (7.1) приведены значения стандартных электродных потенциалов для некоторых систем.
Таблица 7.1
Значения* стандартных электродных потенциалов для некоторых систем.
| Электродная система | 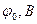
| Электродная система | 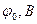
|
| Au / Au+3 | +1,50 | Ni / Ni+ 2 | -0,250 |
| Ag / Ag+ | +0,799 | Fe /Fe+2 | -0,440 |
| Cu / Cu+ | +0,581 | Cr / Cr+3 | -0,74 |
| Cu / Cu+2 | +0,0337 | Zn / Zn+2 | -0,763 |
| H2 / 2H+ | 0 | Mn /Mn+2 | -1,18 |
| Fe / Fe+3 | -0,036 | Na / Na+ | -2,71 |
| Pb / Pb+ 2 | -0,126 | K / K+ | -2,925 |
*Значения стандартных электродных потенциалов в таблице приведены относительно водородного электрода.
Уравнение (7.3) показывает зависимость равновесного потенциала от концентрации соответствующего иона и если концентрация будет равна 1 моль/л, то 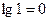 , и равновесный потенциал принимает значение стандартного равновесного потенциала
, и равновесный потенциал принимает значение стандартного равновесного потенциала 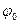 .
.
В таблице (7.1) приведена относительная шкала электродных потенциалов. Она представляет собой количественное выражение так называемого ряда напряжений. Все металлы, имеющие высокий положительный потенциал, носят название благородных металлов, а металлы, которые имеют более низкий потенциал, растворяются в кислотах с выделением водорода.
Дата добавления: 2017-01-29; просмотров: 1140;
