Мембранный потенциал или потенциал Донана.
Если фазовая граница между двумя электролитами проницаема не для всех ионов, то на этой границе может установиться некая равновесная разность потенциалов. Её называют потенциалом Донана или мембранным потенциалом. Ионы, для которых эта граница непроницаема, сохраняются в каждом из электролитов в своей первоначальной концентрации. Такой потенциал наблюдается на клеточных мембранах. Существует он и в организме человека. Благодаря этому потенциалу существует обмен веществ и по существу протекает сама жизнь.
Наиболее широкое применение нашел стеклянный электрод. Впервые он был применён И.Кремером в 1906г. для измерения pH.Устройство стеклянного электрода показано на рисунке 7.3.
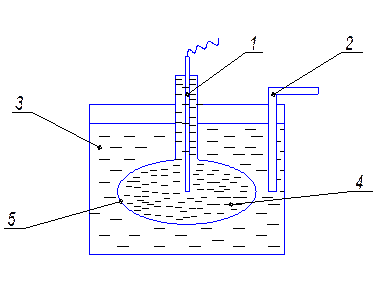
Рис. 7.3 Измерение pH с использованием стеклянного электрода. 1 – металлический проводник; 2 - солевой мостик, соединяющий ячейку с электродом сравнения; 3 –сосуд с исследуемым раствором. 4 – колба со стандартным раствором; 5 – мембрана с толщиной стенки 0,01 – 0,001 мм.
Запишем уравнение Нернста для такой системы:
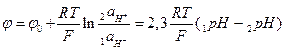 , (7.10)
, (7.10)
где индекс 1 соответствует внутреннему электролиту, а 2 - внешнему.
Очевидно, что такой электрод измеряет разность pH. Это наиболее распространённый метод измерения pH растворов.
Тончайшая мембрана может быть использована для измерения концентрации в принципе любого иона, если через неё протекает или переносится только этот ион. Такие электроды называются ион-селективными. Существуют электроды для определения концентрации 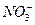 , Cl -, F -, Br – и многих других ионов. При определении концентрации соответствующего иона с помощью ион-селективных электродов определяется разность равновесных потенциалов между этим электродом и электродом сравнения.
, Cl -, F -, Br – и многих других ионов. При определении концентрации соответствующего иона с помощью ион-селективных электродов определяется разность равновесных потенциалов между этим электродом и электродом сравнения.
Приборы для их измерения называются pH –метрами или иономерами. Они состоят из стеклянного (для измерения pH) или ион–селективного электрода (для измерения концентрации какого–либо иона) и измерительного прибора, в качестве которого используется вольтметр с очень высоким входным сопротивлением. Это необходимо для того, чтобы протекающий через систему ток был пренебрежимо малой величины, поскольку система должна находиться в состоянии равновесия. Использование этой системы для расчётов или измерений возможно только в том случае, если выполняется условие химического равновесия.
Вопросы и задачи
1. Определить равновесный потенциал системы Cr+3/Cr относительно насыщенного хлорсеребряного электрода при концентрации Cr+3 в растворе 10-2 моль/л.
2. Определить равновесный потенциал медного электрода (Cu/Cu+2) с концентрацией Cu+2 0,1 моль /л относительно равновесного потенциала системы Fe+2/Fe с концентрацией Fe+2 0,01 моль /л.
3. Каково будет напряжение ячейки, включающей электрод Cu+2/Cu при концентрации Cu+2 1 моль /л и Fe+3/Fe с концентрацией 0,1 моль /л Fe+3, если ток, протекающий в системе бесконечно мал?
4. Определить окислительно-восстановительный потенциал относительно насыщенного хлорсеребряного электрода системы 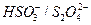 при их равных концентрациях в растворе и рН = 3.
при их равных концентрациях в растворе и рН = 3.
5. Определить напряжение ячейки, состоящей из насыщенного каломельного электрода и платинового электрода, находящегося в равновесии с системой Co3+/Co2+ при эквивалентных концентрациях окисленной и восстановленной форм.
6. Определить напряжение ячейки, состоящей из насыщенного хлорсеребрянного электрода и кадмиевого электрода, находящегося в растворе его соли с концентрацией 0,1 моль /л.
Дата добавления: 2017-01-29; просмотров: 1182;
