Классификация и номенклатура ферментов
Ферменты являются сложными органическими соединениями, присутствующими в живых клетках, где они функционируют как катализаторы различных биохимических реакций превращений разных химических соединений.
История
В 1814 году русский ученый академик К. С. Кирхгоф впервые получил жидкий ферментный препарат амилазы из проросшего ячменя и описал все основные черты ферментативного процесса.
В первой половине XX в. выяснением роли ферментов и микроорганизмов в спиртовом брожении занимались известные ученые Ю. Либих, К. Берн, Л. Пастер.
В 1862 г. А. Я. Данилевским был предложен метод разделения ферментов с помощью избирательной адсорбции.
А 1896 г. считается достоверным началом современной микробной ферментной технологии с получением первого коммерческого продукта новой отрасли – такадиастазы, представляющей собой неочищенную смесь гидролитического фермента, приготавливаемую путем выращивания гриба Aspergillus oryzae на отрубях ячменя.
Ферментная технология включает продукцию, выделение, очистку, использование в растворенной форме и, наконец, применение ферментов в иммобилизованном виде.
Ферменты обладают уникальными свойствами (специфичность действия, нетоксичность, способность работать в мягких условиях, перерабатывать различное сырье растительного и животного происхождения, в том числе и отходы), в связи с чем их применение в промышленности выгодно с экономической и экологической точек зрения.
Традиционно ферментативные препараты получают либо при поверхностном, либо при глубинном способе культивирования продуцента.
Классификация и номенклатура ферментов и ферментных препаратов.
По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов. Классификация была предложена Международным союзом биохимии и молекулярной биологии.
· Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза
· Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата.
· Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов.
· Лигазы, катализирующие образование химических связей между субстратами за счет гидролиза АТФ. Пример: ДНК-полимераза
· Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа
· Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
Номенклатура ферментов
Из более чем 2000 известных в настоящее время ферментов в промышленности используется около 30. Основная часть ферментов, поступающих на мировой рынок, приходится на долю гидролаз.
основным потребителем ферментов является пищевая промышленность. Главное место среди ферментов для пищевой промышленности занимают глюкоизомераза и глюкоамилаза, составляющие около 50 % рынка пищевых энзиматических препаратов.
Микроорганизмы - продуценты ферментов.
Для промышленного получения ферментных препаратов используют как природные штаммы микроорганизмов, выделенные из естественных объектов, так и мутантные штаммы. Продуцентами ферментов могут быть различные микроорганизмы: бактерии, грибы, дрожжи, актиномицеты. Микроорганизмы могут синтезировать одновременно целый комплекс ферментов, но есть и такие, особенно среди мутантных штаммов, которые являются моноферментными и образуют в больших количествах только один фермент.
Поскольку микробные ферменты являются малообъемными препаратами относительно невысокой стоимости, методы, применяемые для их производства, обычно осуществляются с использованием биореакторов. В большинстве случаев ферменты получаются при ферментации с одноразовой загрузкой, длящейся от 30 до 150 часов. В процессе выращивания продуцентов ферментов, последние могут накапливаться внутри клеток или же секретироваться во внешнюю среду.
Основными продуцентами ферментов в промышленных масштабах являются микроорганизмы относящиеся к роду Aspergillus и Bacillus.
АМИЛОЛИТИЧЕСКИЕ ПРЕПАРАТЫ
Амилазы находят применение почти во всех областях, где перерабатывается крахмалсодержащее сырье. Амилазы используют для осахаривания зернового и картофельного крахмала. Самым большим потребителем амилолитических ферментов является спиртовая и пивоваренная промышленности, где в настоящее время солод успешно заменяется амилолитическими ферментными препаратами. Эти препараты используются в хлебопечении, а также в крахмалопаточном производстве для получения различных видов паток и глюкозо-фруктозных сиропов. Высокоочищеииые амилазы применяются для аналитических целей в медицине. Амилолитические ферменты могут применяться в виде поверхностных и глубинных культур, жидких концентратов, сухих препаратов различной степени очистки.
ПЕКТОЛИТИЧЕСКИЕ ПРЕПАРАТЫ
Пектолитические ферменты широко используются в различных отраслях народного хозяйства. Процесс гидролиза пектиновых веществ имеет большое значение для переработки плодов, ягод и овощей. Использование пектолитических ферментов позволяет резко повысить сокоотделение при производстве осветленных соков из плодов и ягод, особенно из тех, которые не имеют собственных пектолитических ферментов и содержат повышенные количества пектина. Использование пектолитических ферментов позволяет на 5—25 % повысить выход сока с единицы перерабатываемого сырья, что дает очень высокий экономический эффект. При изготовлении фруктово-ягодных напитков с мякотью с помощью пектолитических ферментов можно сиять нежелательный желирующий эффект который не позволяет получать концентрированные жидкие соки из-за высокого содержания пектина. Пектолитические ферменты используются в виноделии для увеличения выхода сока из сырья и интенсивности окраски.
ЦЕЛЛЮЛОЛИТИЧЕСКИЕ ПРЕПАРАТЫ
Гидролиз целлюлозы дает глюкозу, которую можно использовать для производства пищевых и кормовых белковых препаратов, получать из нее спирт для энергетических целей, а также она может стать исходным продуктом для производства глюкозо-фруктозных сиропов. Целлюлолитические ферменты с успехом применяют в самых различных производствах (пивоваренная, пищеконцентратная промышленность, хлебопечение, кормопроизводство и др.), где сырьем являются растительные материалы или отходы переработки растений. Использование целлюлаз повышает выходы целевого продукта и позволяет подойти к созданию безотходных технологий.
ПРОТЕОЛИТИЧЕСКИЕ ПРЕПАРАТЫ
Ферменты, обладающие способностью гидролизовать белки, широко используются в самых различных отраслях промышленности, сельском хозяйстве и медицине. Протеиназы применяются в пищевой технологии, где идет процесс с использованием микроорганизмов. Введение в процесс протеиназ позволяет в результате гидролиза белков обрабатываемого сырья обеспечить дрожжам нормальные условия жизнедеятельности, что улучшает весь технологический процесс, особенно в пивоварении, спиртовой промышленности, виноделии. Внесение в тесто небольших количеств амилаз и протеиназ увеличивает газообразование, улучшает аромат, позволяет сократить процесс тестоведения. Широко применяются протеиназы для снятия различного рода белковых помутнений в пивоварении и виноделии и для ускорения фильтрационных процессов. В мясной, рыбной промышленности и в кулинарии используются не только микробные протеиназы, но и протеиназы, получаемые из растительного и животного сырья. Самая большая потребность в протеолитических ферментах связана с их использованием в составе синтетических моющих средств (СМС). Протеолитические препараты применяются для приготовления питательных и диагностических сред, для изготовления ряда лечебных сывороток и вакцин.
ПРЕПАРАТЫ, СОДЕРЖАЩИЕ ГЛЮКОЗООКСИДАЗУ
Применение этих препаратов связано с необходимостью в ряде случаев удалять из продуктов глюкозу. При приготовлении яичного порошка или мясных изделий в высушенном состоянии происходит потемнение готового продукта в связи с образованием меланоидинов при высокой температуре (соединения глюкозы со свободными аминокислотами). Обработка продукта перед сушкой глюкозооксидазой позволяет перевести глюкозу в глюконовую кислоту, что исключает образование повышенной цветности в сухом продукте. Очищенные препараты глюкозооксидазы могут быть использованы как лекарственное средство при обработке наружных ран и ожогов.
ПРЕПАРАТЫ ГЛЮКОЗОИЗОМЕРАЗЫ
Полноценным заменителем сахарозы может служить инвертный сахар, который можно получить не только из сахарозы, ио и из крахмала путем последовательной обработки его ферментами. Наиболее часто в качестве источника глюкозоизомераз используют актиномицеты. В подавляющем числе случаев глюкозоизомераза является внутриклеточным ферментом, накопление которого в клетке совпадает с накоплением биомассы продуцентом и обычно соответствует 16—20 ч роста культуры. Буквально для нескольких продуцентов наблюдается выход глюкозоизомеразы во внешнюю среду, но он, как правило, совпадает с началом автолитических процессов в культуре и соответствует 3—7 сут роста микроорганизма.
ПРЕПАРАТЫ β-ФРУКТОФУРАНОЗИДАЗЫ
Препараты β-фруктофуранозидазы применяются в технологических процессах, где необходима инверсия сахарозы. Наиболее широко фермент используется в кондитерской промышленности. Эти изделия быстро черствеют при хранении, так как с потерей влаги наблюдается явление кристаллизации сахарозы. Если в рецептуру добавлять β –фруктофуранозидазу, то будет происходить медленный гидролиз сахарозы уже в готовой конфете. Есть данные по применению фермента в хлебопечении. Использование препарата улучшает аромат, пористость и внешний вид хлеба. Препараты фермента используются при приготовлении иивертных сиропов в ликероводочной и особенно в безалкогольной промышленности с концентрацией сахара до 72—73 %. Сиропы такой концентрации можно приготовить, не инвертируя сахарозу, но они очень быстро кристаллизуются, что затрудняет работу с ними. Фермент может использоваться как аитикристаллизатор при изготовлении сгущенного молока, искусственного меда, плодово-ягодных морсов, соков, экстрактов и варенья.
Изоферменты, или изоэнзимы — это различные по аминокислотной последовательности изоформы или изотипы одного и того же фермента, существующие в одноморганизме, но, как правило, в разных его клетках, тканях или органах.
Изоферменты, как правило, высоко гомологичны по аминокислотной последовательности и/или подобны по пространственной конфигурации. Особенно консервативны в сохранении строения активные центры молекул изоферментов. Все изоферменты одного и того же фермента выполняют одну и ту же каталитическую функцию, но могут значительно различаться по степени каталитической активности, по особенностям регуляции или другим свойствам.
Примером фермента, имеющего изоферменты, является гексокиназа, имеющая четыре изотипа, обозначаемых римскими цифрами от I до IV. При этом один из изотипов гексокиназы, а именно гексокиназа IV, экспрессируется почти исключительно в печени и обладает особыми физиологическими свойствами, в частности её активность не угнетается продуктом её реакции глюкозо-6-фосфатом.
Ещё одним примером фермента, имеющего изоферменты, является амилаза — панкреатическая амилаза отличается по аминокислотной последовательности и свойствам от амилазы слюнных желёз, кишечника и других органов. Это послужило основой для разработки и применения более надёжного метода диагностики острого панкреатита путём определения не общей амилазы плазмы крови, а именно панкреатической изоамилазы.
Третьим примером фермента, имеющего изоферменты, является креатинфосфокиназа — изотип этого фермента, экспрессируемый в сердце, отличается по аминокислотной последовательности от креатинфосфокиназы скелетных мышц. Это позволяет дифференцировать повреждения миокарда (например, при инфаркте миокарда) от других причин повышения активности КФК, определяя миокардиальный изотип КФК в крови.
■ органоспецифические или индикаторные ферменты, специфичные только для определённого типа тканей.
В сыворотке крови активность клеточных ферментов низка или вообще отсутствует. При патологических процессах активность ферментов этой группы в сыворотке крови зависит от скорости высвобождения из клеток, которая в свою очередь определяется скоростью и степенью их повреждения.
Секреторные ферменты (церулоплазмин, псевдохолинэстераза, липопро-теиноваялипаза) поступают непосредственно в плазму крови и выполняют в ней специфические функции. Эти ферменты синтезируются в печени и постоянно высвобождаются в плазму. Их активность в сыворотке крови выше, чем в клетках или тканях. В клинической практике они представляют интерес, когда их активность в сыворотке крови становится ниже нормы за счёт нарушения функции печени.
Экскреторные ферменты образуются органами пищеварительной системы (поджелудочной железой, слизистой оболочкой кишечника, печенью, эндотелием жёлчных путей). К ним относятся а-амилаза, липаза, щелочная фосфатаза и др. В норме их активность в сыворотке крови низка и постоянна. Однако при патологии, когда блокирован любой из обычных путей экскреции, активность этих ферментов в сыворотке крови значительно увеличивается.
Измеряемая активность ферментов может быть обусловлена наличием весьма близких по свойствам, но несколько отличающихся друг от друга молекулярных форм ферментов. Эти различные формы получили название изоферментов. Исследование изоферментов в клинической практике представляет интерес, когда отдельные изоферменты образуются в разных тканях (например, в сердце и печени преобладают различные изоферменты ЛДГ).
Для количественной оценки активности ферментов Комиссия по ферментам Международного биохимического союза рекомендовала стандартную международную единицу (МЕ). За единицу активности любого фермента принимают то его количество, которое в оптимальных условиях катализирует превращение 1 мкмоль субстрата в 1 минуту (мкмоль/мин).
Об активности фермента судят по скорости катализируемой реакции при определённых температуре и рН среды, концентрации субстрата. Поэтому при определении активности ферментов необходимо строго соблюдать одни и те же условия.
Ферментативная реакция чувствительна к изменениям температур. Обычно её принято проводить при температуре, лежащей в пределах
25-40 °C, однако при разной температуре оптимальные значения рН, концентрации буфера, субстрата и других параметров различны. Максимальную активность большинства ферментов в организме человека наблюдают при температуре приблизительно 37 °C. Поэтому в целях международной стандартизации измерения активности ферментов проводят при данной температуре. Ниже нормальные величины активности ферментов приведены для температуры 37 °C.
Исследование ферментов применяют в клинической практике для решения различных задач: установления диагноза, проведения дифференциальной диагностики, оценки динамики течения болезни, определения эффективности терапии, степени выздоровления и прогноза заболевания. Известно три типа изменений ферментов при патологии: гиперферменте-мия — повышение активности ферментов по сравнению с нормой, гипо-ферментемия — её снижение, дисферментемия — появление в крови ферментов, в норме не обнаруживаемых.
Источник:http://www.medn.ru/statyi/issledovaniefer.html
| Читайте также: 1. Наследственные энзимопатии 2. Наследственные энзимопатии 3. Энзимотерапия |
ЛЕКЦИЯ № 2
Лигазы (синтетазы)
Изомеразы
Лиазы
Отщепление групп от субстратов по негидролитическому механизму с образованием двойных связей (или наоборот, присоединение по двойной связи). Реакции обратимы, за исключением отщепления СО2.
В реакцию вступает 1 вещество и 2 образуются (или наоборот): -SХ-SY- ↔ XY + -S=S-
Систематическое название субстрат: что отщепляется–лиаза
L-малат ↔ фумарат + Н2О
L-малат: гидро–лиаза [фумараза]
Взаимопревращения оптических, геометрических, позиционных изомеров. В реакцию вступает 1 вещество и 1 образуется. Исходя из типа катализируемой реакции выделяется несколько подклассов: 1) рацемазы; 2) эпимеразы; 3) таутамеразы; 4) цис,- трансизомеразы; 5) мутазы (при внутримолекулярном переносе группы); 6) цикло-, оксоизомеразы.
Систематическое название субстрат–вид изомеризации–изомераза
Фумаровая к-та ↔ малеиновая к-та
фумарат–цис,транс–изомераза
или субстрат–продукт–изомераза
гл-6ф ↔ фр-6ф гл-6ф–фр-6ф–изомераза
Соединение 2 молекул с использованием энергии макроэргических соединений (АТФ и др). В реакцию вступают 3 вещества, образуется 3 вещества.
Систематическое название субстрат: субстрат–лигаза (источник энергии)
АТФ + L-глутамат + NH4+ → АДФ + Фн + L-глутамин
L-глутамат: аммиак–лигаза (АТФ → АДФ + Фн) [глутаминсинтетаза]
Тема: Клиническая энзимология – энзимопатии,
Факультеты: лечебно-профилактический, медико-профилактический, педиатрический.
2 курс.
Энзимология – это раздел биохимии, изучающий ферменты и катализируемые ими реакции. Медицинская энзимология – это раздел биохимии, изучающий применение ферментов в медицине. В области медицинской энзимологии выделяют три основных направления исследований: энзимопатология, энзимодиагностика и энзимотерапия.
Энзимопатология – это частная медицинская энзимология, которая изучает молекулярные основы развития патологического процесса, вызванного нарушением механизмов регуляции активности или синтеза ферментов.
Энзимопатии – это группа заболеваний, которые вызваны различными дефектами ферментов. Энзимопатий делятся на: наследственные (первичные) и приобретенные (вторичные). Приобретенные энзимопатии делятся на алиментарные, токсические и вызванные различными патологическими состояниями организма, например нарушениями КОС, повышением температуры тела и т.д. Приобретенные энзимопатии, по-видимому, наблюдаются при всех болезнях.
Причиной наследственных энзимопатий является генетически обусловленная недостаточность или полное отсутствие синтеза ферментов. Дефектные ферменты наследуются, в основном, по аутосомно-рецессивному типу. Гетерозиготы, чаще всего, не имеют фенотипических отклонений. При наследственных энзимопатиях происходит нарушение определенных метаболических путей, возникает дефицит их конечных продуктов и накопление промежуточных продуктов, что приводит к клиническим проявлениям.
Особенностью течения наследственных энзимопатий является наличие скрытого периода, когда болезнь клинически не проявляется, но может быть заподозрена или установлена на основании биохимических исследований. Обычно первые клинические симптомы врожденных энзимопатий обнаруживаются в раннем детском возрасте. Многочисленные патологические состояния, обусловленные дефицитом одного или нескольких ферментов, характеризуется большим разнообразием течения; прогноз их различен.
Классификация наследственных энзимопатий до конца не разработана, обычно их разделяют по типу нарушений метаболизма:
1. нарушения метаболизма аминокислот: фенилкетонурия, альбинизм, алкаптонурия и др.;
2. нарушения углеводного обмена: галактоземия, наследственная непереносимость фруктозы, гликогенозы;
3. нарушения липидного обмена: липидозы;
4. нарушения метаболизма нуклеиновых оснований: подагры, синдрома Леш-Нихана и др.;
5. нарушение обмена в соединительной ткани: мукополисахаридозы, хондродистрофия и др.;
6. дефекты ферментов в ЖКТ: муковисцидоз, целиакия, непереносимость лактозы и др.
7. нарушения обмена стероидов и т.д.
Пример: фенилпировиноградная олигофрения – наследственное заболевание, приводящее в раннем детстве к гибели ребенка или к развитию тяжелой умственной отсталости. Молекулярный дефект заключается в блокировании превращения незаменимой аминокислоты Фен в Тир:
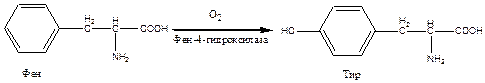
Оказалось, что фермент, катализирующий данную реакцию, Фен-4-монооксигеназа, - не синтезируется в клетках печени, единственном органе, где он в норме открыт. Это приводит к развитию тяжелого наследственного заболевания, обусловленного избыточным накоплением самого Фен и продуктов его побочного пути обмена – фенилпировиноградной кислоты, а затем фенилмолочной и фенилуксусной кислоты в ткани мозга и сыворотке крови больных детей. Обычно диагноз ставят на основании химического метода открытия Фен или фенилпировиноградной кислоты на пеленках детей. Лечение в основном сводится к исключению из питания ребенка Фен. Для такого ребенка Тир оказывается незаменимой аминокислотой.
Развитие другого тяжелого наследственного заболевания – галактеземии (непереносимость молочного сахара), связано с отсутствием синтеза в клетках печени фермента, катализирующего превращение галактозы в глюкозу. Следствием подобной аномалии является накопление галактозы в тканях и развития катаракты в раннем возврате, поражение тканей печени и мозга, нередко приводящие к гибели ребенка. Лечение в данном случае сводиться к исключению из диеты молочного сахара.
Аллиментарные энзимопатии – это стойкие нарушения активности ферментов, связанные с характером питания:
1. отсутствием или снижением в пище количества белка;
2. дефицитом в пище витаминов, макро- и микроэлементов, некоторых низкомолекулярных биологически активных веществ;
3. нарушением соотношения в пище белков, жиров и углеводов;
Токсические энзимопатии обусловлены избирательным угнетением активности или синтеза отдельных ферментов или неспецифическим угнетением биосинтеза белка в результате длительного воздействия токсических агентов. Токсическим агентами являются соли тяжелых металлов,…..
Токсические агенты могут находиться не только в чужеродных соединениях, но и в пищевых продуктах. Например:
1) ингибиторы, содержащиеся в соевых продуктах, яйцах домашней птицы угнетают активность протеаз ЖКТ - трипсина, химотрипсина, эластазы.
2) Антивитамины, присутствующие в некоторых пищевых продуктах, или разрушают витамины или конкурентно замещают их в молекулах ферментов, что приводит к угнетению активности этих ферментов.
3) цианиды или оксиды углерода (II) угнетают активность ферментов, содержащих в активном центре Fe2+.
4) Длительное действие фторидов угнетает активность ферментов, содержащих в активном центре Mg2+ .
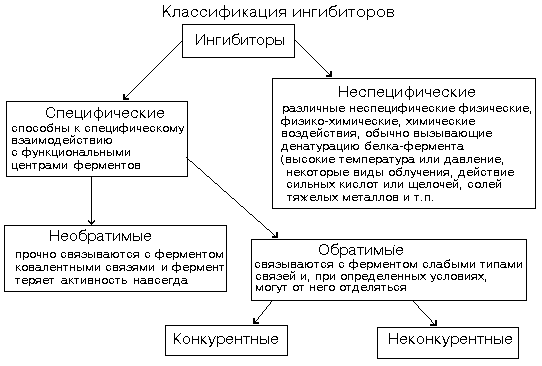
Ингибиторы ферментов - это вещества, замедляющие ферментативные реакции.
Дата добавления: 2017-01-13; просмотров: 1779;
