Характеристика конкурентных ингибиторов
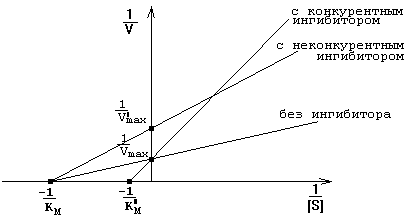
Конкурируют с субстратом за обладание активным центром фермента. По структуре они похожи на субстрат. Присоединяются к адсорбционному центру фермента: действуют на стадии I-го этапа ферментативного катализа. Поэтому конкурентные ингибиторы увеличивают Km и уменьшают сродство фермента к субстрату. Они не изменяют Vmax ферментативной реакции: при повышении концентрации субстрата действие конкурентных ингибиторов можно преодолеть - молекулы конкурентного ингибитора постепенно вытесняются субстратом с активного центра фермента.
ХАРАКТЕРИСТИКА НЕКОНКУРЕНТНЫХ (АЛЛОСТЕРИЧЕСКИХ) ИНГИБИТОРОВ
Связываются с аллостерическим центром фермента. Происходят изменения конформации аллостерического центра, а затем, через всю молекулу, они передаются на каталитический центр. Изменение конформации каталитического центра вызывает снижение активности фермента. Поэтому неконкурентные ингибиторы уменьшают Vmax - снижают скорость протекания II-го этапа ферментативного катализа. Не влияют на Km и не изменяют сродство фермента к субстрату.
Действие обратимых ингибиторов на кинетические константы представлено на графике зависимости 1/V от 1/[S] (график Лайнуивера-Берка) - смотрите рисунок.
|
Измеряя скорость реакции при разных концентрациях субстрата в присутствии и в отсутствие ингибитора, можно не только распознать тип ингибирования, но и по степени изменения Км или Vmaxколичественно оценить степень сродства данного ингибитора к ферменту ("Ферменты", стр. 27-36).
АВТОНОМНАЯ САМОРЕГУЛЯЦИЯ ФЕРМЕНТАТИВНЫХ ПРОЦЕССОВ
Существуют различные механизмы регуляции процессов, протекающих в организме.
3 уровня регуляции:
1) Самый молодой уровень филогенетически - нейрогуморальная регуляция (с участием центральной нервной системы, классических гормонов и гормонов местного действия)
2) Регуляция на генетическом уровне - изменение скорости биосинтеза белка.
3) Филогенетически наиболее старый уровень - автономная саморегуляция ферментов.
Автономная саморегуляция - это регуляция, которая происходит благодаря только самим участникам реакции, то есть за счет фермента, его субстрата (или субстратов) и/или продуктов деятельности данного фермента. Фермент не только работает, но еще и сам себя регулирует.
Механизмы автономной саморегуляции очень многочисленны, но построены на двух основных принципах.
1) Механизмы, основанные на кинетических свойствах фермента, количественно характеризуемых Км и Vmax - это механизмы кинетического типа.
2) Второй принцип связан с аллостерическими свойствами фермента, то есть со способностью фермента угнетаться или активироваться под действием субстрата и/или продуктов. Это механизмы аллостерического типа.
Такие аллостерические механизмы есть не у каждого фермента. Они обычно накладываются на механизмы кинетического типа и определяют особенности регуляции данного фермента.
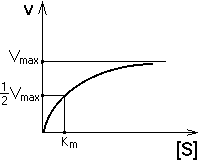
инетика данной ферментативной реакции описывается уравнением Михаэлиса-Ментен и кривой, изображенной на рисунке.
|
Если в клетку поступает мало субстрата, то он медленно и расщепляется. При изменении скорости поступления субстрата в клетку фермент работает так, чтобы поддержать концентрацию субстрата в клетке около Км.
На этот механизм могут накладываться механизмы аллостерического типа:
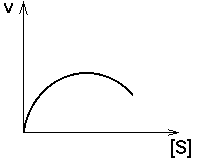
1. СУБСТРАТ или ПРОДУКТ - аллостерический ИНГИБИТОР своего фермента.
|
При чрезмерном поступлении субстрата в клетку скорость утилизации субстрата все больше будет замедляться. Так происходит, когда избыток продукта реакции опасен для клетки (опаснее, чем избыток субстрата).
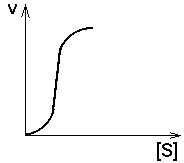
2. СУБСТРАТ - аллостерический АКТИВАТОР своего фермента.
|
Кинетическая кривая имеет S-образный характер, то есть имеет 2 перегиба, как кривая диссоциации оксигемоглобина. В этом случае концентрация субстрата удерживается более эффективно на постоянном уровне и в более узком диапазоне, чем в предыдущем случае.
3. ПРОДУКТ реакции - аллостерический АКТИВАТОР своего фермента.
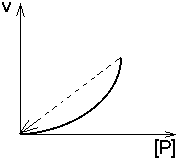
|
Кинетическая кривая имеет лавинообразный (взрывообразный) характер. С увеличением концентрации субстрата скорость реакции, как обычно, возрастает. Это приводит к накоплению продукта, который активирует свой фермент. Это приводит к накоплению продукта, который активирует фермент, в результате продукт накапливается еще быстрее, а фермент активируется еще сильнее. Скорость реакции становится очень большой, и реакция протекает мгновенно до полного расщепления субстрата. Примеры: реакция образования фибрина из фибриногена; система иммунохимической защиты организма.
4. ОДИН СУБСТРАТ - ДВА ФЕРМЕНТА И ДВА ПРОДУКТА.
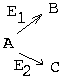
|
В общем случае кинетические кривые этих двух реакций не совпадают.
|
При малых концентрациях субстрата "А" будет преимущественно протекать 1-я реакция, то есть наибольшая часть вещества "А" будет превращаться в "В", а меньшая часть - превращаться в "С". При увеличении концентрации "А" все больше субстрата станет превращаться в "С" по второму пути. При некоторой концентрации "А" (в точке пересечения кривых) скорости обеих реакций сравняются. В этой точке половина вещества "А" будет превращаться в "В", а вторая половина - в "С". Если концентрацию "А" повышать дальше, то начнет преобладать второй путь превращений - в вещество "С". Такой механизм регуляции встречается, когда опасно накопление в клетке не только избытка вещества "В", но и избытка субстрата "А". И поэтому клетка при высоких концентрациях "А" направляет его на образование безопасного продукта С. Путь из "А" в "С" - это резервный путь метаболизма (альтернативный путь). Если на такой механизм накладываются аллостерические механизмы регуляции, то они могут стать более точными. Например, если продукт "В" - аллостерический ингибитор своего фермента Е1 или аллостерический активатор фермента Е2, то переключение на резервный (альтернативный) путь будет происходить более четко.
ОДИН СУБСТРАТ, ДВА ФЕРМЕНТА И ОДИН ПРОДУКТ
Одна и та же химическая реакция в организме может катализироваться разными белками-ферментами. В таком случае они называются изоферментами - это разные молекулярные формы одного и того же фермента. Они могут отличаться обычно очень незначительно. Например, в молекуле один или несколько аминокислотных остатков могут быть заменены другими. Но этого достаточно, чтобы возникли различия в значениях ИЭТ, оптимальном значении рН для действия фермента (рН-оптимум), и в субстратной специфичности, и в величинах Vmax и Km. Называют такие ферменты, как правило, одинаково, но добавляют к названию номер или иное дополнение (для идентификации). И в этом случае, если определять кинетику ферментативных реакций изоферментов, то кривые будут отличаться друг от друга. Если ферменты находятся в клетках разного типа, то изоферменты будут определять специфику метаболизма своих клеток.

|
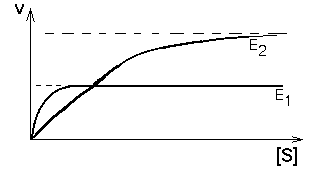
Но если изоферменты находятся в одной клетке, то их кинетические кривые будут сливаться в одну общую кривую, которая имеет двухступенчатую форму. Такая система регуляции работает при разных концентрациях субстрата, которые изменяются в очень широких пределах. Наличие двух изоферментов позволяет успешно превращать субстрат и при малых, и при больших концентрациях субстрата. Характер суммарной кинетической кривой приведен на рисунке.
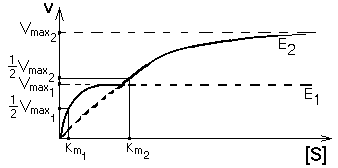
|
Конкретным примером такого типа регуляции служит пара ферментов - гексокиназа и глюкокиназа в печени. Км гексокиназы составляет около 0,02 ммоль/л. В клетках печени кроме гексокиназы есть глюкокиназа, имеющая Км=20 ммоль/л.
В норме концентрация глюкозы в крови колеблется в пределах от 3,9 до 6,1 ммоль/л. Так как Кмгексокиназы в 100 раз меньше, чем реальная концентрация глюкозы в клетке, то гексокиназа всегда работает со скоростью, близкой к Vmax. Благодаря высокому сродству к своему субстрату - глюкозе именно гексокиназа обеспечивает связывание глюкозы в печени в период голодания. На высоте пищеварения, когда концентрация глюкозы в системе воротной вены может составлять десятки ммоль/л, гексокиназа уже не справляется с превращением такого большого количества глюкозы. Наибольшая часть ее превращается глюкокиназой - мощным ферментом, Км которого достигает 20 ммоль/л. Поэтому глюкоза эффективно связывается клетками печени и в период голодания (за счет работы гексокиназы), и на высоте пищеварения (с помощью глюкокиназы). Благодаря такому механизму уровень глюкозы в крови, оттекающей от печени, поддерживается на нужном уровне при любых колебаниях ее концентрации в системе воротной вены.
НЕРАЗВЕТВЛЕННЫЕ МУЛЬТИФЕРМЕНТНЫЕ СИСТЕМЫ
В большинстве случаев тот или иной биохимический процесс катализируется не одним ферментом, а целой совокупностью ферментов, каждый из которых катализирует свой этап в длинной последовательности отдельных реакций этого процесса.
Совокупность ферментов, катализирующих последовательные реакции единого процесса, называется мультиферментной системой.
E1 E2 E3 E4 En
А → В → C → D → L → M
1. В такой системе концентрация любого промежуточного метаболита от "В" и до "L" будет поддерживаться постоянной даже в условиях значительных колебаний скорости всего процесса в целом. Концентрация любого метаболита зависит только от соотношения кинетических констант 2-х ферментов - того, который ведет к образованию этого метаболита, и того, который подвергает его следующему превращению. Например, концентрация вещества "С" зависит от кинетических констант ферментов Е» и Е3. Оба этих фермента, как и вся цепь, могут ускорять свою работу, но концентрация "С" будет оставаться неизменной. Эти механизмы регуляции мультиферментных систем поддерживают постоянство состава внутренней среды организма.
2. В большинстве случаев величины Vmax у всех ферментов данной системы различны. Значит, у какого-то из ферментов Vmax меньше Vmax любого другого фермента. Такой фермент (с низкой Vmax) называется лимитирующим ферментом данной мультиферментной системы. Именно этот фермент определяет скорость процесса в целом.
Как правило, лимитирующими являются те ферменты, которые находятся в начале данной мультиферментной системы. Как правило, эти ферменты подвергаются воздействию регуляторных воздействий со стороны аллостерических эффекторов (в рамках автономной саморегуляции). В таких мультиферментных системах аллостерическими эффекторами бывают часто не только продукт или субстрат данной реакции, но и другие метаболиты - в особенности конечные продукты (М). Если конечный продукт оказывает активирующее действие, то этот механизм называется положительной обратной связью и процесс протекает взрывообразно - до полного исчерпания субстрата в системе.
Если конечный продукт - ингибитор лимитирующего фермента - то говорят об отрицательной обратной связи, и при увеличении концентрации конечного продукта скорость процесса будет замедляться. Если лимитирующий фермент является одновременно и регуляторным, то его называют КЛЮЧЕВЫМ ферментом данной мультиферментной цепи.
РАЗВЕТВЛЕННЫЕ МУЛЬТИФЕРМЕНТНЫЕ СИСТЕМЫ.
Часто мультиферментные цепи являются разветвленными. В таких системах ключевые ферменты обычно предшествуют участкам ветвления, а сразу за разветвлением находятся пункты вторичного контроля, то есть такие ключевые ферменты, которые регулируют скорость реакций в своей ветви:
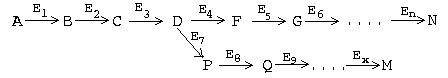
|
В этом примере Е1 - ключевой фермент, а Е4 и Е7 - пункты вторичного контроля.
Дата добавления: 2017-01-13; просмотров: 1215;
