Многие лекарства являются конкурентными ингибиторами ферментов. В основе действия некоторых токсичных веществ лежит ингибирование активности ферментов.
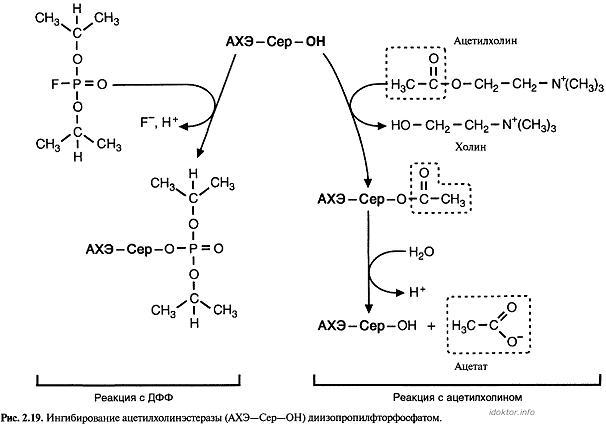
Пример 2.Органические фторфосфаты типа ди-изопропилфторфосфата (ДФФ) являются ядами, потому что ковалентно связываются с остатком се-рина в активном центре некоторых ферментов.
Диизопропилфторфосфати подобные соединения связываются в активном центре ферментов, которые используют остаток серина для гидролитического расщепления.
Симптомы отравления органическими фтор-фосфатами связаны в основном с необратимым ингибированием фермента — ацетилхолинэсте-разы (АХЭ).
Ацетилхолинэстеразаускоряет гидролиз ацетил-холина, функционирующего в качестве нейроме-диатора (рис. 2.19). Продукты распада ацетилхолина — ацетат и холин — не способны действовать как нейромедиаторы. Гидролиз ацетилхолина — важный этап в проведении нервного импульса.
Увеличение количества ацетилхолина в синапти-ческой щели при ингибировании АХЭ приводит к стойкой деполяризации постсинаптической мембраны и может вызвать паралич.
ДФФ и подобные фторфосфаты образуют кова-лентную связь с остатком серина в активном центре АХЭ. Ингибирование является необратимым, и активность АХЭ восстанавливается только после синтеза новых молекул фермента.
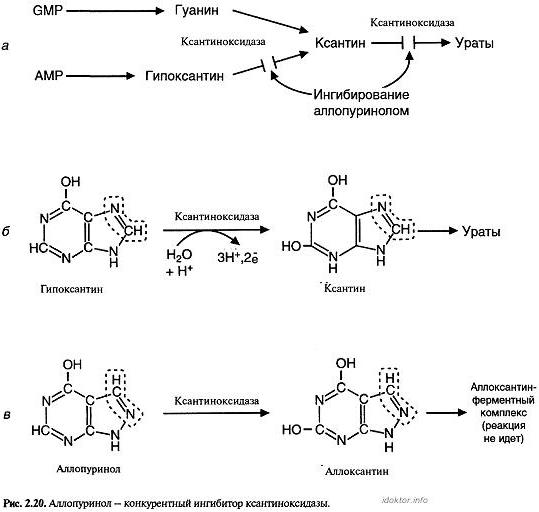
Пример 3.Лечение подагры аллопуринолом основано на ингибировании ксантиноксидазы.
Наиболее характерный клинический признак подагры — повторяющиеся приступы острого воспаления суставов, что связано с отложением в них кристаллов урата натрия (солей мочевой кислоты). Мочевая кислота — конечный продукт распада пуринов у человека.
На рис. 2.20, а показано, что ксантиноксидазаускоряет окисление гипоксантина в ксантин и ксан-тина в мочевую кислоту.
Донором электронов и кислорода в реакции является вода. Окисление происходит при непосредственном участии молибден-оксо-сульфидного комплекса в активном центре ксантиноксидазы (рис. 2.20, б).
Аллопуринол — структурный аналог гипоксантина,превращается на первой стадии окисления в аллоксантин, который связывается с молибденовым комплексом в активном центре ксантиноксидазы, вызывая ингибирование фермента (рис. 2.20, в).
|
|
Наследственные энзимопатии – это заболевания, вызванные наследственными нарушениями биосинтеза ферментов или их структуры и функции.
В норме:

Полное или частичное нарушения биосинтеза ферментов вызывают дефекты генов регуляторных белков, которые контролируют синтез ферментов:
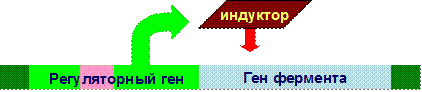
Нарушение структуры и функции ферментов вызывают дефекты генов этих ферментов:

У образовавшегося фермента наблюдаются структурные изменения, которые проявляются в изменении его каталитической активности (как правило, она исчезает), чувствительности к активаторам и ингибиторам, сродству к субстратам, оптимумам рН, температуры. В связи с этим изучением констант фермента является решающим в постановке диагноза врожденных энзимопатий.
Наследственные энзимопатии по типу нарушений метаболизма делят на:
1. нарушения обмена аминокислот: фенилкетонурия, альбинизм, алкаптонурия и др.;
2. нарушения углеводного обмена: галактоземия, наследственная непереносимость фруктозы, гликогенозы;
3. нарушения липидного обмена: липидозы;
4. нарушения обмена нуклеиновых оснований: подагры, синдрома Леш-Нихана и др.;
5. нарушение обмена в соединительной ткани: мукополисахаридозы, хондродистрофия и др.;
6. дефекты ферментов в ЖКТ: муковисцидоз, целиакия, непереносимость лактозы и др.
7. нарушения обмена стероидов и т.д.
В норме метаболический путь протекает следующим образом:

Из-за дефекта в метаболическом пути (цикле, шунте) одного из ферментов в организме происходит накопление промежуточных продуктов (часто токсичных в высоких концентрациях) и дефицит жизненно необходимых конечных продуктов, что приводит к клиническим проявлениям:
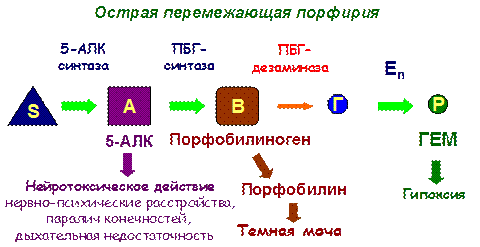
Пример: фенилпировиноградная олигофрения – наследственное заболевание, приводящее в раннем детстве к гибели ребенка или к развитию у него тяжелой умственной отсталости.
Причиной заболевания является отсутствие в печени фермента фен-4-монооксигеназы, которая обеспечивает превращение незаменимой аминокислоты Фен в Тир:
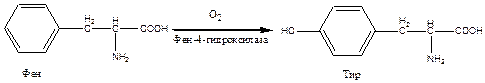
Эта реакция необходима для катаболизма Фен, т.е. удаления его излишков. При отсутствии фен-4-монооксигеназы в организме происходит накопление Фен и превращение его в различные производные: фенилпировиноградную, фенилмолочную и фенилуксусную кислоты.
Фен и его производные в высоких концентрациях токсичны, накапливаясь в тканях, они оказывают на них повреждающее действие. Самой чувствительной к Фен и его производным оказывается нервная ткань детей, она поражается в первую очередь.
Диагноз фенилкетонурия ставят на основании обнаружения Фен в крови или фенилпировиноградной кислоты на пеленках детей. Лечение в основном сводится к исключению из питания ребенка Фен. Для такого ребенка Тир оказывается незаменимой аминокислотой.
Другое тяжелое наследственное заболевание – галактеземия (непереносимость молочного сахара), связано с отсутствием синтеза в печени ферментов, катализирующих превращение галактозы в глюкозу. В результате в раннем возврате происходит накопление в тканях галактозы, приводящее к развитию катаракты, поражению печени, мозга, нередко вызывающее гибель ребенка. Лечение в данном случае сводиться к исключению из диеты молочного сахара.
В основе многих патологических и предпатологических состояний организма лежат нарушения функционирования ферментных систем. Многие ферменты локализуются внутри клеток, а поэтому в сыворотке (плазме) крови их активность низка или вообще отсутствует. Именно поэтому анализируя внеклеточные жидкости (кровь), по активности определенных ферментов можно выявить изменения, происходящие внутри клеток различных органов и тканей организма. другие ферменты постоянно содержатся в крови, в известных количествах и имеют определенную функцию (например, ферменты системы свертывания крови).
Активность ферментов в сыворотке крови отражает сбалансированность скорости синтеза ферментов внутри клеток и выхода их из клеток. Увеличение активности ферментов крови может быть результатом ускорения процессов синтеза, понижения скорости выведения, повышения проницаемости клеточных мембран, действия активаторов, некроза клеток. Уменьшение активности ферментов вызывается повышением скорости выведения фермента, действием ингибиторов, угнетением синтеза.
Повышение активности в крови того или иного фермента является весьма ранним диагностическим тестом. Дополнительное определение изоферментного спектра позволяет уточнить локализацию патологического процесса, так как каждый орган имеет свой определенный изоферментный спектр.
В клинической биохимии большое значение имеет показатель активности аспарататаминотраисферазы и аланинаминотрансферазы. Эти трансаминазы содержатся в митохондриях и в растворимой фракции цитоплазмы клеток. Роль трансаминаз сводится к передаче аминогрупп аминокислот на кетокислоту. Коферментом трансаминаз служит пиридоксальфосфат, производное витамина В6. В крови животных активность обоих ферментов очень мала, по сравнению с их активностью в других тканях. Однако при патологиях, сопровождающихся деструкцией клеток, трансаминазы выходят через мембраны клеток в кровь, где их активность значительно увеличивается по сравнению с нормой. Несмотря на отсутствие строгой органной специфичности этих ферментов, повышение их активности наблюдают при гепатитах, мышечных дистрофиях, травмах, при чрезмерных физических нагрузках на организм, в частности, у спортивных лошадей.
Лактатдегидрогеназа(ЛдГ), гликолитический фермент, катализирующий обратимую реакцию восстановления пировиноградной кислоты в молочную. ЛдГ состоит из четырех субъединиц и включает пять изоферментов. Причем в мышечной ткани преобладает изофермент ЛдГ5, в сердечной мышце ЛдГ1 и ЛдГ2. При остром инфаркте миокарда у больных в сыворотке крови повышается активность изоферментов ЛДГ1 и ЛдГ2. При паренхиматозном гепатите в сыворотке крови значительно возрастает активность изоферментов ЛдГ4 и ЛдГ5, тогда как активность ЛдГ1 и ЛдГ2 снижается.Активность ЛдГ в цельной крови существенно выше активности фермента в плазме крови. Поэтому даже минимальный гемолиз крови значительно изменяет активность фермента в плазме, что следует учитывать в лабораторной работе.
Креатинфосфокиназа(КФК), важную роль играет в энергетическом обмене. Креатинфосфокиназа необходима для ресинтеза АТФ за счет трансфосфорилирования АдФ с креатинфосфатом. Креатинфосфат относится к богатым энергией фосфатным соединениям,которые обеспечивают сокращение мышечного волокна, его расслабление, транспорт метаболитов в мышечную ткань.
Креатин-Ф + АдФ КФК > Креатин + АТФ.
Креатинфосфокиназа состоит из двух субъединиц — М и В, образующих три изофермента: ММ (мышечныий тип), МВ (сердечный тип), ВВ (мозговой тип).
Анализ тканей свидетельствует, что значительная активность КФК имеет место в скелетной мышце,миокарде, мозге. Сердечная мьшца содержит в основном изофермент ММ и МВ.Повышение активности изофермента МВ в сыворотке крови пациента свидетельствует о поражении сердечной мышцы. Определение изоферментов КФК является лучшим методом диагностики при наследственной мышечной дистрофии у цыплят, при недостатке селена у крупного рогатого скота, при паралитической миоглобинурии у лошадей.
Щелочная фосфатаза (ЩФ), — гидролитический фермент, синтезируемый в основном в печени выделяется из организма в составе желчи. Его оптимум активности находится при рН = 8—9. Это неспецифический фермент, катализирующий гидролиз многих фосфорных эфиров и присутствующий в плазме в форме изоферментов. Основной источник щелочной фосфатазы у молодых растущих животных — костная ткань. Активность щелочной фосфатазы значительно повышается при болезнях печени и костей, в частности, при остеомаляциях. Основная роль щелочной фосфатазы, вероятно, связана с отложением фосфатов кальция в костной ткани. Установлено повышение активности щелочной фосфатазы сыворотки крови при новообразованиях кости.
Холинэстераза — фермент, участвующий в процессе передачи нервного импульса, гидролизу ацетилхолин на ацетат и холин. Холинэстераза сыворотки крови включает два вида холинэстераз организма, основной субстрат которых — ацетилхолин. Ацетилхолинэстераза (АХЭ), гидролизирующая ацетилхолин в синапсах, называется истинной. Она присутствует в печени, эритроцитах и лишь малое ее количество локализовано в плазме. Холинэстераза плазмы крови является псевдохолинэстеразой, она гидролизует бутирилхолин в 4 раза быстрее, чем ацетилхолин. Этот фермент находится также в печени, поджелудочной железе, слизистой оболочке кишечника. Синтез АХЭ сыворотки крови происходит в печени, а поэтому при патологии этого органа наблюдается снижение активности фермента.
Необратимыми ингибиторами АХЭ являются токсические фосфорорганические соединения (ФОС). Так,ФОС инсектициды (хлорофос, фосфамид, карбофос, октаметил) избирательно связывают активные центры молекулы АХЭ и тем самым блокируют ее активность. Вследствие высокой липотропности ФОС способны проникать в организм животного через неповрежденную кожу и слизистые оболочки. При отравлении ФОС отмечают беспокойство животного, чувство страха, возбуждение, судороги, которые развиваются на фоне приступов удушья и кашля из-за спазма бронхов. Характерными при этом являются изменения со стороны глаз: резко суживается зрачок, начинается слезотечение, нарушается аккомодация. Чаще всего непосредственной причиной гибели животного, отравленного ФОС является паралич дыхательного центра.
Амилаза продуцируется слюнными железами и в больших количествах поджелудочной железой. Амилаза обладает специфическим действием на с-1,4-глюкозидные связи полисахаридов. Повышение активности амилазы сыворотки крови свидетельствует о развитии острого панкреатита. Умеренное повышение активности фермента отмечается при воспалении слюнных желез.
Энзимотерапия
Энзимы (или ферменты) составляют основу жизнедеятельности живого организма. Все без исключения биохимические процессы происходят при непосредственном их участии. Энзимы обеспечивают защиту организма от вредных воздействий окружающей среды и микроорганизмов (бактерий, вирусов), контролируют обмен веществ, рост и регенерацию тканей, размножение, наконец.
Энзимная недостаточность, возникающая при генетических нарушениях или под воздействием как внешних, так и внутренних факторов может привести к ряду серьезных заболеваний.
Хорошо известно то, что недостаток энзимов, скажем в пищеварительном тракте, можно восполнить препаратами этих веществ, производимых поджелудочной железой или же то, что протеолитические энзимы можно использовать для очистки ран и других – внешних и внутренних – поврежденных участков организма. Это примеры локальной (местной) энзимотерапии.
Когда же речь идет о целенаправленно составленных энзимных смесях гидролитических энзимов, лечебная эффективность которых основана на комплексном воздействии на ключевые процессы, происходящие в организме, мы говорим о системной энзимотерапии.
Метод системной энзимотерапии основан на кооперативном терапевтическом воздействии целенаправленно составленных смесей гидролитических ферментов растительного и животного происхождения. Благодаря влиянию на ключевые патофизиологические процессы в организме, препараты системной энзимотерапии обладают противовоспалительным, противоотечным, фибринолитическим, иммуномодулирующим и вторично анальгезирующим действием. Кроме того, назначение данных препаратов приводит к снижению активности воспалительных процессов и модуляции физиологических защитных реакций организма.
Системная энзимотерапия как новый метод лечения была предложена известным американским врачом и биохимиком профессором Максом Вольфом совместно с биохимиком Хеленой Бенитез в начале прошлого века. Именно они эмпирическим путем составляли и испытывали разные комбинации энзимов. Они же доказали, что крупные белковые молекулы энзимов способны всасываться из просвета тонкого кишечника в кровь в неизмененном виде. Другу и соратнику М. Вольфа профессору Карлу Рансбергеру, одному из основоположников нового метода лечения, принадлежит основная роль по внедрению системной энзимотерапии в лечебную практику. Благодаря нему, например в Германии, препараты вобэнзим, флогэнзим, вобэ-мугос Е стали одними из наиболее распространенных и часто применяемых лекарств.
Отечественными учеными показано успешное использование системной энзимотерапии в ревматологии (при ревматоидном артрите, ювенильном ревматоидном артрите, системной красной волчанке, системных васкулитах и т.д.), сосудистой хирургии (для лечения тромбофлебитов, перифлебитов, атеросклеротическом поражении сосудов и др.), гинекологии и урологии (при урогенитальных хламидиозах, хронических аднекситах и т.д.), травматологии и ортопедии (в лечении травм, в том числе спортивных, эндопротезировании тазобедренных суставов и др.).
Дата добавления: 2017-01-13; просмотров: 1347;
