Кофакторы и коферменты
Для обозначения веществ, способствующих эффектам ферментов и субстратов, применяют общий термин кофактор. К числу облегчающих ферментативный катализ кофакторов относят, таким образом, ионы, которые выполняют роль активаторов, или простетические группы ферментов. Другую важную группу относящихся к этой категории веществ составляют коферменты. Эти вещества в противоположность неорганическим кофакторам относятся к сложным органическим веществам; их молекулы значительно меньше по размеру, чем молекулы ферментов, так что они могут свободно проникать сквозь мембраны; нагревание обычно не вызывает их инактивации.
Коферменты непосредственно участвуют в ферментативном катализе, функционируя в качестве переносчиков электронов, атомов или групп атомов.
В большинстве случаев часть структуры кофермента составляет тот или иной из витаминов — органических веществ, которые не синтезируются в организме человека и должны быть доставлены ему в составе пищевого рациона. В молекуле кофермента активным компонентом, соединяющимся с переносимой группой, служит именно этот структурный компонент (витамин). Остальная часть молекулы кофермента обеспечивает весьма специфическое связывание таких групп в активном центре фермента при строго определенной ориентации.
Это связывание может быть слабым и обратимым, подобно тому как это имело место в рассмотренных выше примерах связывания субстрата или некоторых ионных активаторов. В других случаях такое связывание может быть исключительно прочным и необратимым; кофермент при этом функционирует как составная часть активного центра фермента, т. е. как простетическая группа. Тяжелые болезни, возникающие у человека при недостатке витаминов в пище, служат непосредственным следствием нарушений обмена веществ в результате снижения концентрации коферментов специфических ферментативных реакций.
Коферменты, или коэнзимы — малые молекулы небелковой природы, специфически соединяющиеся с соответствующими белками, называемыми апоферментами, и играющие роль активного центра или простетической группы молекулы фермента.
1. Ингибиторы ферментов. Типы ингибирования активности ферментов
Известно, что активность ферментов сравнительно легко может быть уменьшена с помощью разнообразных воздействий. Такое снижение скорости ферментативных реакций принято называть торможением активности, или ингибированием ферментов.
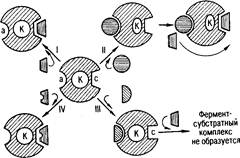
Рис 1. Схема активирования и ингибирования действия фермента (по Ю. Б. Филипповичу): а. – аллостерический центр фермента; К - каталитический центр; с - субстратный центр
Ферменты являются белками, соответственно их активность можно снизить или полностью ликвидировать путем воздействий, приводящих к денатурации белков (нагревание, действие концентрированных кислот, щелочей, солей тяжелых металлов и т.п.) Это неспецифическое подавление активности ферментов, имеющее значение при изучении ферментативных реакций, не представляет особого интереса для исследования их механизма. Гораздо большее значение имеет исследование ингибирования с помощью веществ, специфически и обычно в небольших количествах взаимодействующих с ферментами – ингибиторов ферментов. Расшифровка механизмов многих биологических процессов, таких как гликолиз, цикл Кребса и других, стала возможной лишь в результате применения специфических ингибиторов различных ферментов (Н.Е. Кучеренко, Ю.Д. Бабенюк и др., 1988).
Некоторые ингибиторы ферментов являются для организма животных и человека эффективными лекарственными веществами, другие — смертельными ядами (В.П. Комов, В.Н. Шведова, 2004).
Ингибиторы взаимодействуют с активными центрами молекулы фермента, инактивируя функциональные группы белков. Они могут взаимодействовать с металлами, входящими в состав молекул ферментов и фермент-субстратных комплексов, инактивируя их. Высокие концентрации ингибиторов разрушают четвертичную, третичную и вторичную структуры молекулы фермента, вызывая его денатурацию (А.И. Кононский, 1992). Недавно открыты антиферменты (антиэнзимы, или антизимы), представляющие собой белки, действующие как ингибиторы ферментов. К подобным веществам относятся, например, ингибитор трипсина, обнаруженный в соевых бобах, и сывороточный антитрипсин. Недавно открыт в печени животных антифермент орнитиндекарбоксилазы. Антизимы, вероятнее всего, образуют труднодиссоциируемые комплексы с соответствующими ферментами, выключая их из химических реакций. Иногда ингибитор является составным компонентом предшественника фермента, или входит в состав сложных комплексов ферментов. Однако до сих пор не выяснено, являются ли подобные антиферменты истинными ингибиторами или регуляторными субъединицами.
Если ингибитор вызывает стойкие изменения пространственной третичной структуры молекулы фермента или модификацию функциональных групп фермента, то такой тип ингибирования называется необратимым. Чаще, однако, имеет место обратимое ингибирование, поддающееся количественному изучению на основе уравнения Михаэлиса-Ментен. Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное
На практике многие ингибиторы не проявляют тех свойств, которые характерны для чисто конкурентного или чисто неконкурентного ингибирования. Другой способ классификации ингибиторов основывается на характере места их связывания. Одни из них связываются с ферментом в том же месте, что и субстрат (в каталитическом центре), а другие — на значительном расстоянии от активного центра (в аллостерическом центре) (Р. Марри, Д. Греннер и др., 1993).
Ферментативный ингибитор — вещество, замедляющее протекание ферментативной реакции. Различают обратимые и необратимые ингибиторы (см. ниже).
Изучение ингибирования ферментов играет важную роль в создании лекарств, в изучении механизма действия и структуры ферментов.
Содержание
[убрать]
· 1 Обратимое ингибирование
o 1.1 Конкурентное ингибирование
o 1.2 Неконкурентное ингибирование
o 1.3 Бесконкурентное ингибирование
§ 1.3.1 Ингибирование субстратом
· 2 Необратимое ингибирование
· 3 Аллостерическое ингибирование
· 4 Ссылки
Обратимое ингибирование[править | править вики-текст]
Конкурентное ингибирование[править | править вики-текст]
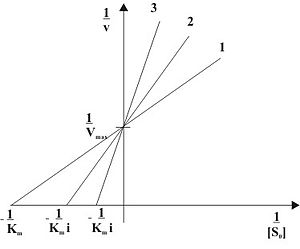
Рис. 2: Конкурентное ингибирование при различных концентрациях ингибитора в двойных обратных координатах ( 1 ... [I]=0, 2 ... [I]>0, 3 ... [I]>[I]2)
В этом случае ингибитор связывается в активном центре фермента и конкурирует за него ссубстратом. Таким образом, конкурентный ингибитор не связывается с фермент-субстратным комплексом (ES на рис.1), то есть константа диссоциации Ki' >> 1.
Конкурентный ингибитор обычно структурно схож с субстратом, однако фермент не способенкатализировать реакцию в присутствии ингибитора из-за отсутствия у последнего необходимых функциональных групп.
Схема конкурентного ингибирования и уравнение Михаэлиса-Ментен для него выглядят следующим образом:
| E+S⟶ES⟶E+P +I↓↑ EI | v0=Vmax[S][S]+Km(1+[I]Ki) |
Видно, что при конкурентном ингибировании максимальная скорость реакции Vmax не меняется, а кажущаяся константа Михаэлиса увеличивается в (1 + [I]/Ki) раз. Поэтому в двойных обратных координатах Лайнуивера-Берка(зависимость 1/v0 от 1/[S]) при разных концентрациях ингибитора получают семейство прямых с различным наклоном, пересекающихся в одной точке на оси ординат.
Константу ингибирования Ki обычно определяют так: проводят ряд измерений кажущейся константы Михаэлиса при различных концентрациях ингибитора, затем строят зависимость этой величины от концентрации ингибитора. Тангенс угла наклона полученной прямой равен Km/Ki.
Неконкурентное ингибирование[править | править вики-текст]
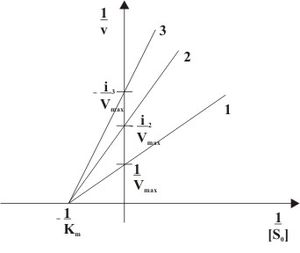
Рис. 3: Неконкурентное ингибирование в двойных обратных координатах при различных концентрациях ингибитора ( 1 ... [I]=0, 2 ... [I]>0, 3 ... [I]>[I]2)
Неконкурентный ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу с одинаковой эффективностью. Ингибитор вызывает такие конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату.
Схема и уравнение Михаэлиса-Ментен в случае неконкурентного ингибирования:
| E+S⟶ES⟶E+P +I↓↑ ↑↓+IEI ↔ ESI | v0=Vmax(1+[I]Ki)[S][S]+Km |
При неконкурентном ингибировании константа Михаэлиса не изменяется, а максимальная скорость реакции уменьшается в (1 + [I]/Ki) раз. Поэтому в двойных обратных координатах семейство прямых, отвечающих разным концентрациям ингибитора, пересекается в одной точке на оси абсцисс.
Бесконкурентное ингибирование[править | править вики-текст]
При бесконкурентном ингибировании ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом. Субстрат, связываясь с ферментом, изменяет его конформацию, что делает возможным связывание с ингибитором. Ингибитор, в свою очередь, так меняет конформацию фермента, что катализ становится невозможным.
Схема и уравнение Михаэлиса-Ментен в случае бесконкурентного ингибирования:
| E+S⟶ES⟶E+P +I↓↑ ESI | v0=Vmax(1+[I]KI)[S][S]+Km(1+[I]KI) |
Максимальная скорость реакции и кажущаяся константа Михаэлиса уменьшаются в одинаковое число раз. Поэтому в двойных обратных координатах для разных концентраций ингибитора получаем семейство параллельных прямых.
Ингибирование субстратом[править | править вики-текст]
Ингибирование субстратом — частный случай бесконкурентного ингибирования, когда две молекулы субстрата связываются с ферментом, что препятствует образованию продукта.
Схема и уравнение Михаэлиса-Ментен в случае ингибирования субстратом:
| E+S⟶ES⟶E+P +S↓↑ ESS | v0=Vmax[S][S]+Km+[S]2KI |
Необратимое ингибирование[править | править вики-текст]
Формирование стабильного комплекса ингибитора с ферментом, ведущее к его необратимой инактивации. Случай необратимого ингибирования можно обнаружить по тому признаку, что при разбавлении раствора не происходит повышения удельной активности фермента, как в случае обратимого ингибирования
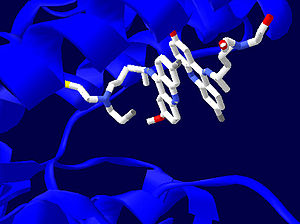
Рис. 4: Структура активного центра трипантионредуктазы с двумя молекулами ингибиторов, один из которых связан необратимо, а другой обратимо. Фермент покаазан синим цветом. Изображение создано на основе PDB 1GXF.
Аллостерическое ингибирование[править | править вики-текст]
Аллостерические ингибиторы связываются с отдельными участками фермента вне активного центра. Такое связывание влечет за собой конформационные изменения в молекуле фермента, которые приводят к уменьшению его активности. Аллостерические эффекты встречаются практически только в случае олигомерных ферментов. Кинетику таких систем нельзя описать с помощью простой модели Михаэлиса-Ментен.
1.Способность к регуляции делает ферменты важными участниками и своеобразными организаторами клеточных процессов в организме человека.Регуляция скорости ферментативных реакций в клетке — основной механизм не только контроля и координации метаболических путей, но и роста и развития клетки, а также ее ответа на изменение окружающей среды.
2. Существует два основных способа контроля скорости ферментативных реакций:
— Контроль количества фермента.
Количество фермента в клетке определяется соотношением скоростей его синтеза и распада.Этот способ регуляция скорости ферментативной реакции является более медленным процессом (проявляется спустя несколько часов), чем регуляция активности фермента (практически мгновенный ответ).
— Контроль активности фермента.
Активность фермента может регулироваться путем взаимодействия с определенными веществами, изменяющими конформацию активного центра.
3. Ферменты, регулирующие скорость метаболических путей:
— обычно действуют на ранних стадиях метаболических путей, в местах ключевых разветвлений метаболических путей;
— катализируют в условиях клетки практически необратимые реакции, протекающие наиболее медленно (ключевые).
Пример 1. Регуляция по принципу обратной связи:в многоступенчатых метаболических путях конечный продукт ингибирует регуляторный (ключевой) фермент процесса.
Первый фермент (Ej) последовательного пути превращения вещества А в вещество Z обычно ингибируется конечным продуктом этого метаболического пути.
 Изменение активности ключевого фермента Е1 происходит в результате изменения конформа-ции после связывания вещества Z в аллостерическом центре— участке, удаленном от активного центра. Фермент Е1 аллостерический.
Изменение активности ключевого фермента Е1 происходит в результате изменения конформа-ции после связывания вещества Z в аллостерическом центре— участке, удаленном от активного центра. Фермент Е1 аллостерический.
Регуляция по принципу обратной связи происходит относительно быстро, и часто это первый ответ клетки на изменение условий.
С другой стороны, фермент Ех будет активным при снижении концентрации вещества Z.
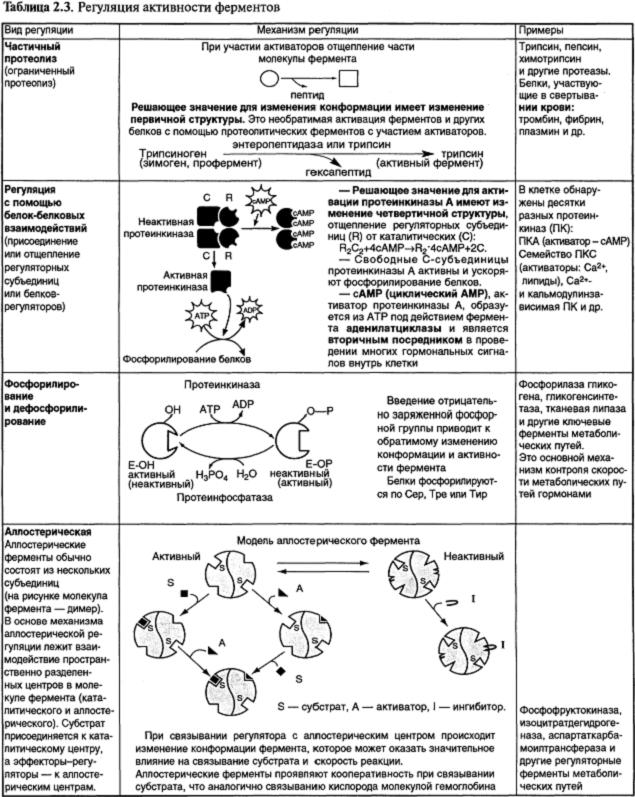
4. Основные виды регуляции каталитической активности ферментов в клетке и структурные изменения ферментов в ходе их активации представлены в табл. 2.3.
5. Нарушение синтеза фермента может привести к энзимопатиям,при которых недостаток одного фермента в метаболическом пути может вызвать нарушение образования конечного продукта. В силу взаимозависимости метаболических путей дефект одного фермента часто приводит к целому ряду нарушений в обмене веществ:
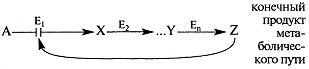 Существует вероятность, что избыточно накопленный субстрат может перейти на побочный путь метаболизма с образованием необычного и часто токсичного вещества Bj.
Существует вероятность, что избыточно накопленный субстрат может перейти на побочный путь метаболизма с образованием необычного и часто токсичного вещества Bj.
6. Отдельные примеры энзимопатий (дисахаридозы, гликогенозы, агликогенозы, фенилпирови-ноградная олигофрения) будут рассмотрены при изучении следующих разделов.
Дата добавления: 2017-01-13; просмотров: 5281;
