Органические соединения. Теория Бутлерова
Органические соединения — соединения углерода — характеризуются большим разнообразием свойств. Причиной этого является особенность углерода, выделяющая его из всех остальных элементов, — совпадение значений валентности и координационного числа, равных 4. Атомы углерода в органических соединениях связаны ковалентной неполярной связью.
Теория строения органических соединений была впервые сформулирована в 1861 г. А. М. Бутлеровым. Он писал: «Исходя от мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определенным количеством принадлежащей ему химической силы (сродства), я называю химическим строением распределение действия этой силы, вследствие которого химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу» ... «химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением». Изучение химических превращений и физических свойств соединений дает возможность установить последовательный порядок связи атомов между собою и во многих случаях предвидеть свойства изучаемых веществ.
В основу теории строения легло явление изомерии. Этот факт впервые правильно объяснил А. М. Бутлеров, подчеркнув, что различие свойств изомеров объясняется различием порядка связи атомов между собой в изомерных молекулах. Формуле С2Н6О соответствуют два вещества — этиловый спирт и диметиловый эфир. Свойства этих веществ очень различны. Этиловый спирт — жидкость с температурой кипения 78,32°, а диметиловый эфир — газ с температурой кипения —21°. Этиловый спирт реагирует с металлическим натрием, диметиловый эфир не реагирует
Сопоставлением ряда свойств этих веществ можно этиловому спирту
Н Н Н Н
| | | |
приписать строение Н—С—С—ОН, а диметиловому эфиру Н—С—О – С—ОН
| | | |
Н Н Н Н
Изображенные структуры могут быть подтверждены рядом химических превращений и физическими свойствами.
Теория строения учит, что атомы внутри молекулы взаимно влияют друг на друга. Свойства соединений являются следствием взаимного влияния атомов и групп атомов, непосредственно соединенных друг с другом. Например, в молекуле спирта связь кислорода с водородом обнаруживается благодаря способности такого водорода вытесняться металлами:
C2H6O+Na → C2H5ONa+ ½ H2.
Отмечено, что и атомы, непосредственно друг с другом не связанные, также могут влиять друг на друга, хотя в более слабой степени.
Сравнение свойств кислот: уксусной СНзСООН, хлоруксусной СlСН2СООН и бета-хлорпропионовой С1СН2СН2СООН показывает, что самой слабой является уксусная, а наиболее сильной из этого ряда — хлоруксусная кислота. Объяснение этому явлению можно найти во влиянии атомов хлора на группу —СООН, хотя он с нею непосредственно и не связан. В хлоруксусной кислоте между хлором и карбоксильной группой находится одна группа СН2, а в бета-хлорпропионовой кислоте — две группы СН2. Поэтому бета-хлорпропионовая кислота слабее хлоруксусной, но сильнее обычной уксусной кислоты.
Исходя из теории строения, можно объяснить причины большого разнообразия органических соединений. Такими причинами являются:
1. Четырехвалентность атома углерода и величина его координационного числа (4). Углерод расположен в IV группе элементов периодической системы. Преимущественный тип связей — ковалентный.
H H H Cl Cl
| | | | |
Н - С - Н Н – С – Сl H – C – Cl H – C – Cl Cl – C - Cl
| | | | |
H H Cl Cl Cl
Метан Хлористый Хлристый Хлороформ Четыреххло-
метил метилен ристый
углерод
В очень редких случаях валентность атома углерода не равна четырем. Как правило, такие соединения непрочны, обладают очень высокой химической активностью и длительное время существовать в свободном состоянии не могут.
2. Равноценность валентностей атома углерода. При замещении атомов водорода в молекуле метана, независимо от того, какой из четырех атомов замещен одновалентным: атомом или группой атомов, образующееся производное будет обладать совершенно одинаковыми свойствами.
Равноценность всех четырех валентностей атома углерода объясняется их пространственным расположением. Пересекаясь в одной точке, направления валентностей образуют между собой равные углы.
Геометрически это можно изобразить фигурой тетраэдра, в центре которого находится атом углерода, а его валентные связи направлены к вершинам, образуя между собой углы в 109°28΄. Такое представление об атоме углерода первоначально было высказано Вант-Гоффом и нашло обоснование в квантово-механическом толковании. Рентгеноскопические исследования подтвердили эти положения. В кристалле алмаза, например, все расстояния между атомами углерода совершенно одинаковы и равны 1,54А.
3. Способность атомов углерода соединяться между собой с образованием цепей. Возможны три случая:
а) на соединение атомов углерода между собой затрачивается одна валентность; при этом образуется группировка - 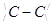 -. В этом случае образовавшуюся между атомами углерода связь называют простой, или одинарной, а соединения — предельными;
-. В этом случае образовавшуюся между атомами углерода связь называют простой, или одинарной, а соединения — предельными;
б) два атома углерода на соединение друг с другом могут затратить по две валентности, образуя группировку 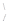 С=С
С=С 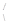 .
.
Такая связь носит название двойной, а соединение—непредельных, или ненасыщенных. Расстояние между атомами углерода в соединениях с двойной связью равно 1,34А;
в) два атома углерода могут образовать группировку -С ≡ С-, т.е. затратить на связь друг с другом по три валентности. Такая связь называется тройной. Соединения имеют ненасыщенный характер. Расстояние между атомами углерода, соединенными тройной связью, составляет 1,20 А.
Двойные и тройные связи называются кратными.
Дата добавления: 2016-12-26; просмотров: 874;
