Электронные структуры органических соединений
Схематически распределение электронов атома углерода может быть изображено следующим образом:
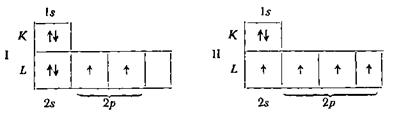
В схеме I на оболочке К имеются два электрона, что может быть записано как 1s2. На оболочке l два электрона находятся на энергетическом уровне s(2s2) и два электрона — на уровнях р (2р2). Для схемы I электронная конфигурация атома углерода может быть записана так: 1s22s22р2.
Исходя из схемы II, электронная конфигурация может быть выражена формулой 1s22s2р3.Схема II соответствует возбужденному состоянию атома углерода (гибридизация).
Как было показано, ковалентная связь может быть образована только за счет одиночных (неспаренных) электронов. Поэтому атом углерода в состоянии 1s22s22р2может образовать только две ковалентные связи, т. е. должен быть двухвалентным. Практика показала, что углерод всегда четырехвалентен и образует четыре ковалентные связи, значит ему соответствует состояние 1s22s2р3.
Благодаря отличительной особенности атома углерода (совпадение координационного числа и валентности) между его атомами образуются только чисто ковалентные связи. Поэтому между молекулами органических соединений очень слабое взаимодействие,, следствием чего можно считать их низкие температуры кипения и плавления. Как правило, простейшие органические соединения являются низкокипящими жидкостями или газами.
Согласно современным представлениям, образование химической связи осуществляется в результате перекрывания электронных облаков двух связующих электронов.
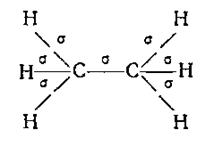
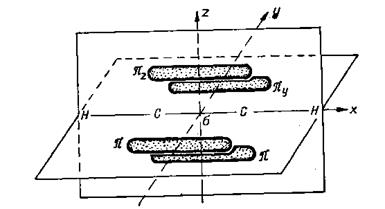
В случае одинарной связи перекрывание облаков электронов происходит по прямой, соединяющей два атома (σ-связи). Так, в молекуле этана все 7 связей являются σ-связями и расположены относительно друг друга под углами 109°28'
В случае двойной связи из двух ее валентных штрихов только один может быть σ-связью; принцип Паули исключает возможность идентичного расположения электронной пары второго штриха. В результате этого в плоскости σ -связей будут находиться все атомы углерода и водорода, а число σ-связей составит пять,
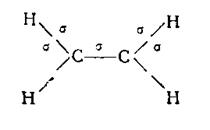
Угол между направлениями валентностей – 120о У каждого
атома углерода остается по одному р-электрону; все они должны
расположиться в плоскости, перпендикулярной плоскости σ-связей. Эти электроны образуют π-связь.
Электроны π-связи имеют форму несколько сплюснутых восьмерок, одна половина которых расположена над плоскостью σ-связей, а вторая — под этой плоскостью.
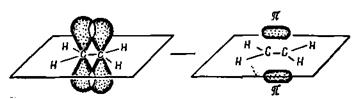
Таким образом, два валентных штриха двойной связи неравноценны, π-связь легко поляризуется, возможна ее ионизация и даже разрыв с образованием свободных бирадикалов:
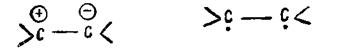
Это придает соединениям, содержащим двойную связь, повышенную химическую активность и ряд особых химических и физических свойств.
При тройной связи σ-связи расположены на одной прямом (угол 180°):
а четыре р-электрона образуют попарно две π-связи, расположенные в двух взаимно перпендикулярных плоскостях.
Особое значение имеют ароматические соединения, простейшим представителем которых является бензол С6Н6, имеющий в обычном изображении формулу
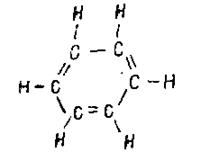
В этой молекуле все атомы углерода и водорода лежат в одной плоскости и образуют
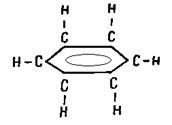
Восьмерки π-электронов расположены над и под плоскостью цикла и, взаимно перекрываясь, образуют единую систему, в которой все связи совершенно равноценны. Таким соединениям присущ особый комплекс химических и физических свойств—ароматические свойства.
Дата добавления: 2016-12-26; просмотров: 668;
