ОБЩАЯ ХАРАКТЕРИСТИКА БЕЛКОВ
Белки – это высокомолекулярные органические соединения, являющиеся сополимерами аминокислот. В природе существует примерно от 1010 до 1012 различных белков, составляющих основу всех видов живых организмов. Огромное многообразие белков обусловлено способностью 20 α-аминокислот взаимодействовать друг с другом с образованием полимерных соединений с молекулярной массой от 6 тысяч и до 1 миллиона (и более) дальтон. Поэтому белки отличаются длиной цепи, количеством каждой из 20-ти аминокислоты, порядком их очередности. Отсюда очевидно, что число вероятных аминокислотных последовательностей практически неисчерпаемо. Аминокислотный состав белков не одинаков и является важнейшей их характеристикой, определяется наследственной информацией, закодированной в ДНК.
Аминокислоты, входящие в состав белков, являются амфотерными электролитами, обладают свойствами как кислот, так и оснований.
Аминокислоты, входящие в состав белков, могут быть заменимыми и незаменимыми (не синтезируемыми в организме). Поэтому белки, содержащие все 8 незаменимых аминокислот, называют полноценными, лишенные (лимитированные) одной или нескольких - неполноценными. Степень полноценности зависит также от оптимального их соотношения в белке.
В связи с огромным разнообразием белков, различием их химических, физических и биологических функций классификация и номенклатура белков разработаны далеко не полностью. На сегодняшний день наиболее удачной считается классификация по структурным признакам с определенным сочетанием характерных физико-химических свойств белков.
Все белки по составу подразделяются на:
Ø простые (протеины);
Ø сложные (протеиды), в состав которых входят:
Ø глюкоза – гликопротеиды;
Ø липиды – липопротеиды;
Ø пигменты – хромопротеиды.
Ø нуклеиновые кислоты – нуклеопротеиды.
По пространственному расположению:
Ø фибриллярные (склеропротеины) – состоят из вытянутых или спирализованных полипептидных цепей, расположенных параллельно, полипептидные цепи объединены в волокна (фибриллы). Нерастворимы в воде.
Ø глобулярные (сферопротеины) – состоят из одной или нескольких полипептидных цепей, плотно свернутых за счет ковалентных и нековалентных связей в компактную частицу, называемую глобулой. Обычно хорошо растворимы в воде.
По количеству цепей в молекуле:
Ø олигомеры (больше, чем 1 цепь);
Ø протомеры (1 отдельная цепь).
По растворимости:
Ø альбумины – в воде и разведенных солях в интервале рН = 4-8,5;
Ø глобулины – в нейтральных растворах солей сильных кислот, нерастворимы в воде;
Ø глутелины – в разведенных щелочах и кислотах (содержат 45% глутаминовой кислоты);
Ø проламины – в 50-90%м этаноле (до 45% глутаминовой кислоты и 15% пролина);
Ø гистоны – низкомолекулярные, основные, растворимые в воде и кислотах.
Все белки имеют определенную пространственную структуру, которая очень сложная, но построена по определенным закономерностям. Основными уровнями строения белковой молекулы приняты:
Ø первичная;
Ø вторичная;
Ø третичная;
Ø четвертичная.
В молекуле белка линейная последовательность размещения аминокислот строго определена, характерна только для данного вида белка и определяет его природную структуру. Эта последовательность является уникальной и называется первичной структурой. В основе образования первичной структуры лежит пептидная связь, разрушаемая только при жестком химическом, физическом или термическом воздействии.
R1 – СО – NН - R2 – СО – NН - R3 - …….- СО – NН - Rn
Вторичная структура образуется в результате взаимодействия атома водорода одной цепи и атома кислорода другой или той же самой цепи с образованием водородной связи NH…O=CH-
Из-за большого количества образовавшихся водородных связей цепь белковой молекулы скручивается в спираль. Когда образование водородной связи невозможно из-за возникновения дисульфидных связей или наличия аминокислоты пролина, образуется изгиб или петля.
Кроме спиралевидной образуется еще и складчатая вторичная структура, характерная для коллагена – фибриллярного белка. Особенностями вторичной структуры объясняется различное отношение белков к внешним воздействиям. Так, спираль разрушается легко, тогда как коллаген очень стоек.
Полипептидные цепочки в белке определенным образом группируются и фиксируются в пространстве с помощью взаимодействия белковых групп одной цепи или нескольких. Такая структура также уникальная для каждого вида белка, называется третичной. В ее образовании принимают участие:
Ø дисульфидная связь R1-S-S-R2 (между группами -SH соседних участков);
Ø водородные мостики R1-C=O…H-N-R2;
Ø ионная связь R1-CО;
Ø O-H3N-R2;
Ø солевые мостики;
Ø эфирные связи.
Для многих белков характерна четвертичная структура – это объединение нескольких одинаковых по первичной, вторичной, третичной структуре белковых молекул. Четвертичную структуру имеет, например, гемоглобин.
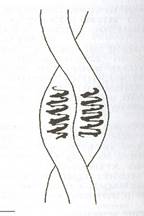

а) б) в)
Рис. 2.1. Схема структуры белка
а – вторичная, б - третичная; в - четвертичная
Каждая из перечисленных структур определяет свойства белковой молекулы. Суммарные свойства неизменного белка называется нативными свойствами.
С другой стороны, каждая из форм очень чувствительна к воздействию внешних факторов и может изменяться под их влиянием, вследствие свойства белка также изменяются.
Свойства белков
Белки, как сложные полимерные соединения, характеризуются определенными физико-химическим показателями. Это молекулярная масса, наличие определенных полярных групп, определенное значение изоэлектрической точки, оптические свойства, показатель преломления и т. д. Эти свойства проявляются в связи с тем, что белок – химическое вещество с наличием в своем составе определенных химических соединений.
Помимо физико-химических, существуют еще и функциональные свойства белка. Их оценивают как возможность белка – вещества выполнять ту или другую функцию в технологическом процессе. Под функциональными свойствами подразумевают так же физико-химические характеристики белков, определяющие их поведение при переработке в пищевые продукты и обеспечивающие определенные структуру, технологические и потребительские свойства.
Физико-химические свойства нативного белка – это его объективная характеристика, а функциональные свойства зависят от многих условий, т. е. их можно корригировать. Технологу необходимо знать, при каких условиях белок максимально проявляет свои функциональные свойства.
Существует понятие и технологические свойства – это общие свойства пищевых продуктов, которые реализуются в технологическом процессе. Так как практически все продукты питания состоят из нескольких пищевых веществ, то технологические свойства этих продуктов проявляются как функциональные свойства их составных частей.
В технологическом плане многие продукты используются с учетом того, что их технологические свойства объясняются присутствием белка как носителя функциональных свойств. Существует много функциональных свойств, желательных в белоксодержащих продуктах. Для наглядности приведем примеры некоторых функциональных свойств, необходимых или желательных в производстве тех или иных продуктов.
Растворимость – используется для достижения необходимой консистенции, создания коллоидной системы (например, напитки).
Водоудерживающая способность – используется при приготовлении рубленых мясных и рыбных фаршей, замесе теста.
Эмульгирующая способность – используется при приготовлении соусов эмульсионного типа (майонезы), рубленых мясных изделий, колбас.
Пенообразующая способность – используется в изделиях с пенной структурой (бисквитное тесто, кремы, муссы, самбуки, мороженое и т. д.).
Когезионная способность – проявляется при замесе различных видов теста, приготовлении фаршевых изделий, использовании панировки.
Текстурность – (способность расслаиваться, крошиться и т. д.) – используется при приготовлении песочного, слоеного тесто, текстурированных продуктов, хлебобулочных изделий.
Студнеобразующая способность - используется при приготовлении студней, джемов, желе, колбасных изделий.
Функциональные свойства определяются природой белка и характером взаимодействия с другими компонентами пищевой системы.
Функциональные свойства зависят от структуры и состояния белка и могут корригироваться параметрами технологического процесса.
Функциональные свойства обуславливаются поверхностными характеристиками белка на уровне первичной структуры, соотношением межмолекулярных и внутримолекулярных связей различных типов, аминокислотной последовательности, вторичной и третичной структурой, определяющими пространственную доступность.
Дата добавления: 2016-12-26; просмотров: 2436;
