ИЗМЕНЕНИЕ БЕЛКОВ В ТЕХНОЛОГИЧЕСКОМ ПРОЦЕССЕ
Гидратация белков
Из всех компонентов продуктов питания наибольшее влияние на их свойства оказывает вода. Во многих пищевых продуктах на ее долю приходится наибольший удельный вес. Характер воздействия воды на процессы, протекающие при производстве пищевых продуктов, определяется, прежде всего, количеством воды и формой связи ее с другими компонентами, в основном с белками.
По количеству влаги пищевые продукты целесообразно подразделять на три основные группы:
Ø продукты с высокой влажностью (более 40% воды);
Ø со средней или промежуточной влажностью(10…40% воды);
Ø с низкой влажностью (менее 10% воды).
Влажность пищевых продуктов непосредственно связана с таким показателем их качества, как активность воды (аw), величина которой влияет на течение химических реакций размножение микроорганизмов в продукте.
Различают четыре формы связи влаги с материалом, и, в частности, с компонентами пищевых продуктов: химическую, адсорбционную, осмотическую и капиллярно-связанную.
Химически связанная – это вода молекулярных соединений в виде кристаллогидратов.
Адсорбционно-связанная вода – образуется в результате притяжения диполей воды полярными группами, расположенными на поверхности субстрата.
Пищевые продукты представляют собой капиллярно-пористые тела с порами различного диаметра, которые могут быть заполнены жидкостью. Капилярно-связанная влага образуется в результате адсорбции воды стенками капилляров.
Осмотически связанная вода – это влага, которая адсорбируется в клетках пищевого продукта за счет разности концентраций растворенных веществ.
Гидратация белков пищевых продуктов в основном обусловлена адсорбционно- и химически связанной водой.
Способность белков связывать воду является одним из характерных физико-химических свойств, играющих исключительно важную роль в технологии пищевых продуктов. С гидрофильностью связаны такие процессы, как набухание и растворимость белков, их осаждение и денатурация при воздействии жестких физико-химических факторов среды.
Гидратацией называется процесс связывания воды сухими веществами или структурой продукта. Это сложный коллоидный процесс, в котором используют термин степень гидратации. Под степенью гидратации подразумевают способность сухих веществ, в том числе и белковых, переводить воду из структурно свободной в состояние структурно связанной, а так же то, насколько эта способность реализована.
Гидратация белков – важнейший фактор устойчивости их растворов. Молекулы гидратной воды можно представить в виде одного слоя вокруг полярных и ионизированных групп белка. Неполярные участки белка (в случае их наличия в белке) свободны от воды. Такая вода прочно удерживается белком и называется адсорбционной.
Адсорбционная вода удерживается белками достаточно прочно и не может служить растворителем для других веществ. Количество связанной воды для различных белков составляет около 0,15-0,35 г на 1 г белка.

Рис 2.2. Схема вероятного присоединения молекул воды к полярным группам белка
1 – связь структуры первого порядка; 2 – связь структуры
второго порядка
Адсорбционная вода удерживается белком благодаря образованию между их молекулами водородных связей, которые относятся к разряду относительно слабых. Однако это свойство компенсируется значительным их числом: каждая молекула воды способна образовывать 4 водородные связи, которые распределяются между полярными группами белка и соседними молекулами воды.
Различают ионную и молекулярную адсорбцию, что связано с наличием в белке свободных и связанных полярных групп.
Свободные полярные группы (аминогруппы, карбоксильные группы дикарбоновых кислот) диссоциируют в растворе, определяя величину суммарного заряда молекулы. Адсорбирование воды ионизированными свободными полярными группами белка называется ионной адсорбцией. Эта величина может быть изменена изменением рН среды. Связанные (пептидные группы полипептидных цепей, гидроксильные, сульфгидрильные и др.) присоединяют воду за счет молекулярной адсорбции, которая является постоянной величиной для белка.
При низком содержании белка в растворе, их молекулы полностью гидратированы и не способны к дополнительной гидратации (например, молоко, жидкое тесто, омлеты и др.).
В концентрированных белковых растворах при дополнительном добавлении воды происходит дополнительная гидратация белков (добавление воды к измельченному мясу в определенных количествах), поскольку способность белковых веществ связывать воду значительно больше, чем физически присутствующее количество воды в продукте. К таким продуктам принадлежат мясо, рыба, яйца. При последующей тепловой обработке в результате денатурации белков и структурообразования получается студень, удерживающий всю содержащуюся в белковом растворе влагу. Эффективность дополнительной гидратации в данном случае заключается в улучшении реологических показателей студня – снижении его механической прочности и упругости.
В студнях молекулы белка удерживают много воды вследствие образованной гидратной сетки из белковых молекул и тяжей, но количество воды строго определенно для каждого вида белка.
Чем длиннее и тоньше молекула белка, тем меньше концентрация его необходима для образования студня, поэтому большинство студней обводнены больше, чем концентрированные растворы. Это явление используется при варке студней из частей туш с максимальным содержанием соединительной ткани, имеющей фибриллярную структуру белков.
При производстве полуфабрикатов во время смешивания компонентов процесс гидратации складывается из растворения и набухания. При этом мягкость изделий повышается, они лучше формуются, улучшается сочность, консистенция, вкус готового изделия (котлетная масса).
При гидратации белковых веществ различают ограниченное и неограниченное набухание.
Неограниченное - приводит к образованию растворов (молекулы белка отрываются друг от друга и переходят в раствор).
Ограниченное- не заканчивается растворением.
Набухание белков в процессе гидратации имеет выборочный характер относительно растворителя (необходимо вспомнить классификацию белков относительно растворителя).
Так как белки имеют полярные группы, то набухают они в полярных растворителях - вода, спирты.
На степень и кинетику набухания белков в растворителях влияют:
Ø температура;
Ø давление;
Ø величина рН среды;
Ø наличие электролитов и их концентрация;
Ø степень измельчения;
Ø "возраст" полимера.
Минимальное набухание и наибольшая способность белков к агрегации наблюдается в изоэлектрической точке (ИЭТ). При сдвиге рН среды в ту или иную сторону от изоэлектрической точки усиливается гидратация белка. В технологической практике это используется для усиления их водосвязывающей способности (маринование мяса). Использование кислотосодержащих маринадов снижает рН мяса до 3,0…3,5, т.е. ниже изоэлектрической точки основных белков мяса. При тепловой обработке такое мясо меньше обезвоживается.
В мясной промышленности дополнительная гидратация белков мяса достигается добавлением пищевых фосфатов, смещающих рН мяса в нейтральную или слабощелочную сторону.
Гидратация зависит от вида продукта и состояния белков в нем. Классическим примером гидратации является образование теста из муки. Сухие белки муки, крупы, бобовых, которые содержатся в них в виде высохшей цитоплазмы и алейроновых зерен, при контакте с водой набухают, образуя сплошной более или менее обводненный студень.
Мука состоит преимущественно из сухих белковых гелей и крахмальных зерен, которые, взаимодействуя с водой, проявляют коллоидные свойства, обуславливая образование теста. Ведущая роль в образовании теста принадлежит нерастворимым клейковинным белкам муки, которые в процессе разной степени гидратации образуют клейковину с разными свойствами.
Мясной фарш представляет собой сложную полидисперсную систему, в которой роль дисперсионной среды выполняет водный раствор белков, низкомолекулярных органических и неорганических веществ, а дисперсной фазой служат частицы мышечной, жировой и соединительной ткани, хлеба и других компонентов. Частицы в фарше связаны между собой молекулярными силами сцепления и образуют сплошную объемную сетку. Одновременно частицы взаимодействуют с дисперсионной средой.
Свойства мясного фарша зависят от его состава, степени измельчения, влажности, природы и концентрации растворенных в воде веществ, водосвязывающей способности компонентов и прочности связи между дисперсными частицами.
Степень измельчения мясного сырья определяет характер разрушения клеточной структуры и переход в окружающую среду содержимого клеток, а также величину дисперсных частиц. При увеличении степени измельчения возрастают дисперсность частиц и доля растворенного белка в дисперсной среде, что повышает водосвязывающую способность фарша. Последняя также зависит от качества исходного мясного сырья, и в первую очередь от его рН. Мясо с высоким значением рН (6,2 и более) способно удерживать большое количество воды. Увеличение доли прочно связанной белками воды приводит к нарастанию прочностных свойств в системе, что нежелательно, поэтому количество воды, добавляемой при приготовлении фарша, должно быть таким, что бы сырой фарш хорошо формовался, а готовое изделие было сочным. Поэтому, несмотря на то, что количество воды в рецептурах регламентировано, для получения изделия высокого качества необходимо учитывать качество мясного сырья и добавок (их водосвязывающую способность).
Поваренная соль в концентрации до 0,1…0,15 М способствует гидратации белковых систем за счет ионной гидратации и в результате повышения осмотического давления и увеличения растворимости глобулинов.
При оценке роли гидратационных процессов необходимо иметь в виду, что в пищевых продуктах наряду с адсорбционной водой, прочно связанной с белками, содержится большее или меньшее количество осмотически и капиллярно-связанной воды, которая также оказывает влияние на качество продукции.
Растворимость - один из основных, самых важных показателей функциональности белков и технологических свойств белоксодержащих продуктов.
Еще одним свойством является способность белка растворяться под воздействием технологических факторов. То есть возникают ситуации, когда способный к растворению белок находится в условиях плохой растворимости и наоборот. Таким образом, показатель растворимости может корригироваться параметрами технологического процесса.
Нельзя объединять понятия растворимости и гидратации.
Хотя направление обоих процессов одинаково, они по сути разные. Белковая система, состоящая из нерастворимых белков, вполне может быть гидратирована, то есть перемешена с водой, которая будет удерживаться благодаря силам физической природы. Но при этом белки будут нерастворимы. Изменением рН или введением электролитов гидратированный белок можно перевести в растворимое состояние.
Растворимость белковых систем зависит:
Ø от степени измельчения фазы (молекулярной массы белка);
Ø характера связи фазы с дисперсной средой;
Ø характера самой жидкой среды.
Дегидратация – это процесс обратный гидратации, сопровождается потерей белками воды. Дегидратация белоксодержащих продуктов может быть следствием целенаправленных действий согласно технологического процесса, а также результатом влияния различных нежелательных действий, последствием которых является потеря функциональных свойств белков, например растворимости или влагоудерживающей способности. В технологической практике различают обратимую и необратимую дегидратацию.
Обратимая дегидратация — составная часть целенаправленного технологического процесса, наблюдается при сублимационной сушке. Метод сублимационной сушки основан на способности льда при определенных условиях испаряться, минуя жидкую фазу. При обычной тепловой сушке влага с наружной поверхности материала испаряется, а из внутренних непрерывно перемещается к наружным, вызывая перераспределение водорастворимых веществ, витаминов, солей и др. При сублимационной сушке такого перераспределения не происходит. В процессе сублимационной сушки из продукта удаляется капиллярно-связанная и осмотически связанная вода. Адсорбционно-вязанная вода удаляется не полностью, так как ее мономолекулярный слой, располагающийся ан поверхности белковых молекул, очень прочно связан с белком. Эта вода (гидратная) может быть удалена только пр нагревании до температуры 100оС и выше, что приводит к денатурации белка. Ее количество достигает 5% от массы сухих белков.
Сухая возгонка льда непосредственно в пар способствует сохранению формы высушиваемого продукта, усадки продукта не происходит. По мере сушки образуется сухой высокопористый продукт, представляющий собой каркас с ячейками, равными по величине кристаллам испарившегося льда.
При последующем замачивании гидратная оболочка практически полностью восстанавливается за 5…15 минут.
Сублимации можно подвергать не только пищевые продукты, но и готовые к употреблению блюда. Такие блюда восстанавливаются двумя способами: продукт заливают кипящей водой и варят при слабом кипении 5…10 минут с момента закипания, жир добавляют по рецептуре или продукт заливают кипящей водой, оставляют для набухания на 6…8 минут и кипятят 6…10 минут при осторожном помешивании. Высушенные сублимацией свежие плоды и ягоды восстанавливаются путем погружения в холодную кипяченую воду на 5…8 минут.
Необратимая дегидратация (невозможно восстановить первоначальные свойства продукта) —происходит при размораживании мяса, рыбы и тепловой обработке продуктов. При быстром размораживании мяса происходит неполное восстановление белковых коллоидных систем, нарушенных в период замораживания. Дегидратация белков мяса и рыбы связана с денатурацией их при замораживании и последующем хранении. При размораживании этих продуктов часть воды выделяется в окружающую среду в капельно-жидком состоянии. Поэтому рыбу оттаивают в воде, так как нативная структура ее белков не восстанавливается.
При воздействии тепла происходит необратимая денатурация белков с выделением воды вместе с растворенными в ней веществами, что снижает массу изделий, изменяет ее пищевую ценность и органолептические показатели.
Дегидратация — процесс, противоположный гидратации, то есть это процесс выделения влаги из продукта. Это очень важный технологический процесс, который обеспечивает органолептические показатели белоксодержащих изделий и функциональную активность белковых веществ.
Необратимая дегидратация, как правило, сопровождается денатурацией белков.
Так как причинами денатурации является действие тепла, химических веществ, механическое воздействие, течение времени, облучение, то эти же факторы являются и причинами дегидратации.
Одним из факторов дегидратации есть денатурация белков, в результате чего изменяется их агрегатное состояние. Поэтому главным признаком дегидратации является переход коллоидного состояния белковых веществ:
золь – гель
гель I рода – гель II рода
раствор – флокулят
Относительно технологии продукции питания эти переходы воспринимаются как изменение консистенции пищевых продуктов.
Типичным примером целенаправленной дегидратации является получение творога из молока/ Причина — изменение агрегативной стойкости белков под влиянием химических веществ.
Причиной дегидратации могут быть денатурационные изменения под влиянием тепловой энергии. В технологии большинство процессов основано на эффекте тепловой денатурации белковых веществ и, как следствие, необратимой дегидратации. Одновременно процессы денатурации, коагуляции и агрегации приводят к дегидратации белковых систем. Например, приготовление прозрачных бульонов.
Важная роль в дегидратации принадлежит реакции среды. Одни и те же белки при разных значениях рН имеют разную устойчивость к дегидратации. В изоэлектрической точке (ИЭТ) белки находятся в минимальной степени гидратации, способность их удерживать воду наименьшая. Поэтому факторы, вызывающие дегидратацию в ИЭТ действуют с максимальным эффектом.
Это свойство широко используется при получении изолированных белков (изолятов), белковых концентратов, копреципитатов — изменяя рН, добиваются максимальной растворимости белков, переводят их в раствор, затем сепарируют, отделяя нерастворимые частицы, потом подтитровывают до значения ИЭТ, когда он выпадает в осадок, который отцеживают.
На методе дегидратации базируется производство консервированных продуктов и полуфабрикатов. Посол приводит к обезвоживанию продукта и повышению части связанной воды, а следовательно к уменьшению количества микроорганизмов. Дегидратация белков происходит при всех видах сушки, а также при биохимических, осмотических и ферментативных процессах — в период посмертного окоченения.
Важное свойство белков – их способность к денатурации.Денатурация белков в технологии пищевых продуктов рассматривается с нескольких позиций.
Во-первых - фактор, обеспечивающий реализацию понятия кулинарная готовность продукта.
Во-вторых – фактор, позволяющий либо полностью остановить ферментативную деятельность, либо уменьшить ее.
В-третьих – фактор, обеспечивающий соблюдение такого важного показателя как микробиологическая безопасность.
В-четвертых – фактор потери белками своих функциональных свойств и своей видовой специфичности.
Денатурацией называется необратимое изменение нативной вторичной, третичной, четвертичной пространственной структуры белковой молекулы под влиянием внешних факторов.
В зависимости от характера внешнего воздействия различают следующие виды денатурации:
Ø тепловая;
Ø механическая (взбивание, встряхивание);
Ø кислотная или щелочная;
Ø при сушке и замораживании.
Наиболее часто инженеры-технологи сталкиваются с тепловой денатурацией.
При тепловой денатурации разрушаются поперечные связи между боковыми цепями, поэтому изменяется конформация полипептидных цепей в белковой молекуле. У глобулярных белков развертываются глобулы и свертываются по новому образцу. Но прочные пептидные (ковалентные) связи, обеспечивающие первичную структуру белка, сохраняются. Фибриллярный белок коллаген при тепловой денатурации плавится, так как поперечные связи между полипептидными цепями исчезают и образуется стекловидная масса.
Каждый белок имеет индивидуальный температурный диапазон денатурации. Так, для белков рыбы темпратура денатурации близка к 30оС, мяса – 45..60оС, коллагена – 55…60оС.
Тепловая денатурация белка возможна только при наличии воды, кристаллический белок даже при температуре 100°С устойчив к денатурации.
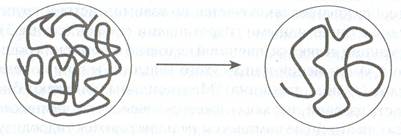
нативный белок денатурированный белок
Рис.2.3. Схема денатурации белка
Чем выше гидратация белка и ниже его концентрация в растворе, тем быстрее он денатурирует. Денатурированный белок:
1) теряет биологическую активность;
2) теряет способность к гидратации (растворению и набуханию);
3) улучшается его атакуемость ферментами;
4) повышается реакционная способность;
5) изменяются физические свойства;
Важное место в технологии занимает изменение коллоидного состояния пищевых продуктов, которое получило название коагуляция. Коагуляция, в зависимости от концентрации и свойств белка, может идти с образованием конечных продуктов с различным агрегатным состоянием. Температурой коагуляции является та наименьшая температура, при которой белок изменяет свое коллоидное состояние.
В малоконцентрированных белковых растворах при тепловой денатурации молекулы белка образуют агрегаты за счет возникновения дисульфидных и водородных связей, при этом получаются крупные частицы, которые при дальнейшей агрегации расслаивают коллоидную систему и образуют хлопья или пленки (бульоны, молоко). Независимо от вида белка малоконцентрированные по белку системы из-за физического недостатка белка не способны к гелеобразованию всей системы. В более концентрированных белковых растворах при тепловой денатурации образуется сплошной гель, удерживающий всю воду (яйцо). Обводненные гели при денатурации уплотняются и происходит выпрессовывание влаги (снижение объема, повышение прочности мяса, рыбы).
Изменение белковых гелей в большой степени зависит от рН среды, температура. Чаще всего создание кислой среды снижает дегидратацию белковых молекул и повышает сочность изделий, нежность. Более высокая температура и продолжительное нагревание усиливает денатурацию. Поэтому технологам необходимо знать температурный верхний предел стабильности белков, чтобы не вызвать денатурации (при приготовлении яично-молочного льезона, горячий способ приготовления бисквита).
Наиболее термостабильны белки молока и яиц, наименее – мяса и рыбы.
Некоторые вещества повышают температуру денатурации белков, например сахароза. Так, нативный белок куриного яйца денатурирует при t = 55°С, меланж – при 70°С, а меланж с сахаром – при 80-83°С. И наоборот, соль и спирт в высоких концентрациях снижают температуру денатурации белка.
Следствием тепловой денатурации белков является изменение их коллоидного состояния, которое называется свертыванием.
Денатурация и свертывание не одно и то же. Можно вызвать денатурацию, не добившись свертывания. Например, при нагревании яичного белка он свертывается. Если белок немного подсушить и нагреть, он денатурирует, но не свертывается, а при нейтрализации среды выпадает осадок. Происходит так потому, что это не истинный раствор, а взвеси в воде нерастворимого в жидкой среде вещества (денатурированного белка).
Существует три типа свертывания:
1) Нативный белок в состоянии разбавленного золя в результате тепловой денатурации коагулирует с образованием хлопьев (при варке мяса образуется пена на поверхности бульона).
2) Нативный белок в состоянии концентрированного золя в растворе в результате тепловой денатурации коагулирует и превращается в гель.
При нагревании неразбавленного яйца масса уплотняется, сохраняет форму. При длительном нагревании гель уплотняется, скорость постденатурационной коагуляции золя зависит от величины их pH.
3) Нативный белок в состоянии геля в результате тепловой денатурации свертывается, т.е. уплотняется, выпрессовывая часть содержащейся в белках жидкости. Процесс наблюдается при производстве творога, при варке мяса.
В практике предприятий питания имеем дело не с чистыми белками, а со смесями их с различными веществами. Коагуляция тормозится концентрированными растворами солей щелочных металлов, жирных кислот, растворами сахаров.
При взбивании яичных белков для бисквита, взбивании сливок, происходит образование пены. Это поверхностная денатурация. Образующаяся пена состоит из пузырьков воздуха, окруженных тонкими белковыми пленками. Образование этих пленок сопровождается развертыванием полипептидных цепей белковых молекул. Таким образом, при взбивании происходит частичная или полная денатурация белка.
В кулинарной практике мы встречаемся и с кислотной денатурацией, которая имеет место при мариновании мяса, сквашивании молока.
При тепловой обработке продуктов изменения белков не ограничиваются их денатурацией. Многие белоксодержащие продукты при кулинарной обработке, нагревают еще некоторое время после того, как произойдет денатурация и свертывание. При продолжительном нагревании наблюдаются еще более глубокие постденатурационные изменения. Гели уплотняются еще более, происходят химические изменения основных молекул, в результате чего выделяются вещества: сероводород H 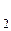 S, аммиак NH
S, аммиак NH 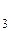 , углекислый газ CO
, углекислый газ CO 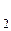 .
.
Расщепляются пептидные связи. При этом происходит деполимеризация молекул с образованием водорастворимых азотистых веществ небелкового характера. Этот процесс называется деструкцией белков.
Деструкция белков - нагревание денатурированного белка свыше 100°С в течение некоторого времени. Процесс деструкции происходит в несколько этапов.
На первом этапе отщепляются функциональные группы с образованием летучих веществ (аммиак, сероводород, углекислый газ, фосфористый водород и др.); накапливаясь в продукте, эти вещества участвуют в образовании вкуса и аромата пищи.
На втором этапе при длительном гидротермическом воздействии белки гидролизуются с расщеплением пептидных связей (переход коллагена в глютин, разрушение внутримолекулярных связей протеолитическими ферментами в тесте, изменение ферментных препаратов для размягчения жесткого мяса, белковых гидролизатов).
Классическим примером тепловой деструкции белков является переход коллагена в глютин, в результате чего образуется глютин. С этим процессом связано размягчение мяса.
Очень перспективным является использование ферментативной деструкции в технологических процессах. ферментативная деструкция белков в мясе происходит постоянно под действием целой группы собственных протеолитических ферментов и обуславливает процессы созревания мяса в послеубойный период. При этом изменяется консистенция, увеличивается нежность и другие показатели, присущие созревшему мясу.
Ферментативная деструкция белков происходит при искусственном ферментолизе белковых продуктов. На этом основаны технологии сыровяленых колбас, вкусо-ароматических концентратов, имитирующих вкус мясных и рыбных бульонов.
Ферментативная деструкция используется при выделении белковых веществ, очистки их от примесей, для высвобождения их из комплексов.
БЕЛКИ МЯСА
Дата добавления: 2016-12-26; просмотров: 6973;
