Приготовление рабочей эмульсии или суспензии из готовых препаратов 2 страница
Константа диссоциации воды (К) определена опытным путем и равна 1,8X10-16 при 22°. Концентрация ионов водорода и гидроксила очень незначительна, так как расчет показывает, что из 556 миллионов молекул воды на ионы распадается только одна. Тем не менее, ионизация воды имеет очень большое значение.
Из выражения (1) имеем: [Н+][ОН-]=К[Н2О]. [Н2О] — концентрация воды в литре 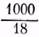 = 55.56 молей воды в одном литре ее. [Н+].[ОН-]=1,8.10-16[55,56]=10-14 (при 22o).
= 55.56 молей воды в одном литре ее. [Н+].[ОН-]=1,8.10-16[55,56]=10-14 (при 22o).
Произведение концентрации водородных [Н+] и гидроксильных [ОН-] ионов в воде и разбавленных водных растворах (выраженных в грамм-ион на литр) называется ионным произведением и обозначается через Кв=10-14 (при 22°).
В чистой воде и нейтральных водных растворах концентрации водородных и гидроксильных ионов (в г-ион/л) равны между собой, так как при диссоциации образуется одинаковое число ионов Н+ и ОН-: [Н+]=[ОН-] =10-7 г-ион/л.
Таким образом, для нейтральной среды имеем: [Н+]=10-7 г ион/л [ОН-] =10-7 г-ион/л.
В кислых средах [Н+] больше [ОН-].
При повышении [Н+] величина [ОН-] уменьшается, но так, что произведение концентрации водородных и гидроксильных ионов остается постоянным и равным Кв=10-14.
В щелочных средах [Н+] меньше [ОН-] и в этом случае произведение концентрации водородных и гидроксильных ионов остается постоянным и равным 10-14. О степени кислотности и щелочности среды можно судить по концентрации ионов водорода.
Если [H+] = 100, 10-1, 10-2, 10-3, 10-4, 10-5, 10-6, то среда кислая; в щелочной среде [Н+] = 10-8, 10-9, 10-10, 10-11, 10-12, 10-13, 10-14.
Водородный показатель рН. Для количественной характеристики реакции среды на практике обычно приводят не концентрацию водородных ионов, а ее отрицательный десятичный логарифм. Эта величина называется «водородным показателем» и обозначается через рН.
Таким образом, рН=-lg[H+]. Например, если [Н+]=10-5, то рН=5; если [H+]=10-7, то рН=7.
Водородный показатель — величина, характеризующая концентрацию водородных ионов и численно равная отрицательному десятичному логарифму этой концентрации, выраженной в грамм-ион на литр. В более кислом растворе концентрация ионов водорода выше, а значение рН меньше, в более щелочном растворе концентрация
Tаблица 9
Концентрация ионов водорода и водородный показатель в различных средах
| Концентрация водородных ионов и водородный показатель | Кислая среда | Нейтральная среда | Щелочная среда | ||
| сильнокислая | слабокислая | слабощелочная | сильнощелочная | ||
| [H+] | 100, 10-1, 10-2, 10-3 | 10-4, 10-5, 10-6 | 10-7 | 10-8, 10-9, 10-10 | 10-11, 10-12, 10-13, 10-14 |
| рH | 0, 1, 2, 3 | 4, 5, 6 | 8, 9, 10 | 11, 12, 13, 14 |
ионов водорода ниже, а значение рН больше (см. табл. 9).
Общая и активная кислотность. Определение рН. Следует различать общую и активную кислотность или щелочность. Общая кислотность (щелочность) характеризуется нормальностью, то есть числом грамм-эквивалентов* кислоты (щелочи), содержащейся в литре раствора. Но количество свободных (активных) ионов водорода (или ионов гидроксила) может быть меньше общего их количества в растворе.
Под активной кислотностью понимают концентрацию свободных (диссоциированных) ионов водорода (или гидроксила). Величина рН дает количественную оценку только активной кислотности или щелочности. При одинаковой нормальной концентрации у различных по силе кислот активная кислотность различна. Так, например,
__________
* Грамм-эквивалентом называется количество граммов вещества, равное его эквиваленту. Эквивалент кислоты равен ее молекулярному весу, деленному на валентность, то есть на число атомов водорода в молекуле кислоты, способных замещаться металлами. Эквивалент основания равен его молекулярному весу, деленному на валентность соответствующего металла. Раствор, содержащий в литре 1 грамм-эквивалент растворенного вещества, называется однонормальным или просто нормальным раствором и обозначается буквой «Н»; 0,1 грамм-эквивалент растворенного вещества — децинормальным — 0,1 Н; 0,01 грамм-эквивалент — сантинормальным — 0,01 Н.
децинормальные (0,1 Н) растворы соляной (НСl) и уксусной (СН3СООН) кислот, имея одинаковую общую кислотность, показывают различные значения рН (для HCI рН=1,02, для СН3СООН рН = 2,89). Так как общая кислотность раствора включает в себя как диссоциированную (активную) часть, так и недиссоциированную часть кислоты, то практически определить ее можно титрованием. При этом к раствору кислоты добавляют столько щелочи, сколько нужно для того, чтобы связать всю кислоту. Так же определяется общая щелочность, только титрование ведут кислотой.
Активную кислотность определяют рН-метрией двумя методами: колориметрически и электрометрически. Колориметрический метод определения рН основан на свойстве некоторых веществ, называемых кислотно-щелочными индикаторами, изменять свою окраску в зависимости от степени активной кислотности или щелочности.
Обычно это азосоединения, производные трифенилметана и другие органические соединения, молекулы которых претерпевают структурные изменения в зависимости от реакции среды. Индикаторы эти (по теории Оствальда) являются слабыми кислотами или слабыми основаниями, окраска которых зависит от степени диссоциации. Например, лакмус окрашивается в красный цвет в кислых растворах и в синий цвет — в щелочных.
Кислотная форма лакмуса, то есть недиссоциированные молекулы, имеет красную окраску, а щелочная форма (анионы) — синюю. При концентрации обеих форм, равных между собой, окраска раствора индикатора будет фиолетовой.
Наш глаз имеет ограниченную способность к восприятию окрасок и обычно перестает замечать присутствие одной из окрашенных форм индикатора наряду с другой его формой, если концентрация ее раз в 10 меньше концентрации последней. Вследствие этого окраска любого индикатора изменяется не при всяком изменении рН, а лишь внутри определенной области значения рН, называемой интервалом перехода индикатора. Каждый индикатор характеризуется интервалом перехода. Так, например, лакмус меняет окраску от красного до синего в пределах рН 5 — 8, фенолфталеин — от бесцветного до красного в пределах 8,2 — 10, метиловый оранжевый — от красного до желтого в пределах 3,1 — 4,4. Покраснение лакмуса указывает на то, что рН используемого раствора 5 или ниже. Посинение лакмуса указывает на то, что рН раствора 8 или выше. Внутри области перехода (рН 5 — 8) глазом будет восприниматься фиолетовая окраска лакмуса.
Для определения рН испытуемого раствора пользуются реактивными бумагами, которые приготавливаются пропиткой тонкой фильтровальной бумаги раствором соответствующего индикатора. Полоску индикаторной бумаги погружают в испытуемый раствор или наносят на нее каплю раствора.
В реставрационной практике удобно пользоваться приблизительным определением рН с помощью универсальных индикаторов. Они представляют собой смеси двух или нескольких индикаторов, подобранных так, чтобы окраска их менялась в широком интервале значений рН.
Одним из удобных универсальных индикаторов является смесь из индикаторов метилового красного и тимолового синего (в 100 мл 70%-ного раствора этилового спирта растворяют 0,375 г тимолового синего и 0,125 г метилового красного) (см. табл. 10).
Таблица 10
Влияние рН раствора на окраску индикатора, приготавливаемого из смеси метилового красного и тимолового синего
| рН | окраска | рH | окраска |
| красная | бледно-зеленая | ||
| оранжевая | зеленая | ||
| желто-розовая | сине-зеленая | ||
| желтая |
Можно применять универсальный индикатор, представляющий собой смесь нескольких индикаторов. Такой индикатор выпускается в продажу под маркой ЭИ В—1.
Еще удобнее проводить приблизительное определение рН с помощью универсальной индикаторной бумаги*. Точность данных, полученных с помощью универсальных индикаторов, — около одной единицы шкалы рН.
В лабораторных условиях после приблизительного определения рН с помощью универсального индикатора проводят точное определение рН раствора методом колориметрического титрования.
Для колориметрического определения рН растворов определяют цвет, который принимает индикатор в испытуемом растворе и в серии стандарт-
__________
* Универсальная индикаторная бумага выпускается лабораторией латвийского отделения Всесоюзного химического общества им. Л. И. Менделеева, Прилагаемая к индикатору цветовая шкала показывает, какие окраски соответствуют различным значениям рН в пределах от 1 до 10.
ных буферных* растворов с различным рН: рН испытуемого раствора равен рН того буферного раствора, к которому цвет испытуемого раствора наиболее близок.
В лабораториях, где постоянно приходится определять рН, пользуются специальным прибором Михаэлиса, а котором имеется комплект пробирок, содержащих рассчитанное количество индикаторов **. Во всех определениях, требующих точности свыше 0,1 рН, а также при исследованиях в мутных и окрашенных растворах пользуются электрометрическим — потенциометрическим способом.
Для таких измерений рН в лабораториях используются рН-метры различных марок, позволяющие производить измерения как в милливольтах, так и в единицах рН по одной и той же шкале. Устройство приборов и правила работы с ними подробно изложены в инструкциях, прилагаемых заводом-изготовителем.
Влияние кислотности и щелочности среды на сохранность произведений. Реакция нейтрализации. Кислотные свойства среды определяются действием водородных ионов; щелочные свойства определяются действием гидроксильных ионов. Водородные и гидроксильные ионы занимают особое место среди других ионов благодаря резко выраженному влиянию их на физико-химические свойства материалов и течение многих химических реакций.
__________
* Буферными называются растворы с устойчивой концентрацией водородных ионов и, следовательно, с определенным рН, почти не зависящим от разведения и лишь слабо изменяющимся при прибавлении к раствору небольших количеств сильной кислоты и щелочи. Такими свойствами обладают растворы, содержащие слабую кислоту или слабое основание совместно с их солью, например уксусную кислоту и уксуснокислый натрий.
** К прибору прилагается подробная инструкция колориметрического определения рН исследуемого раствора.
Многие процессы, обусловливающие ускоренное разрушение произведений живописи, протекают при высокой кислотности или щелочности среды. При наличии кислой среды интенсивно разрушаются целлюлозосодержащие материалы: дерево, бумага, картон, ткани из хлопка, льна, пеньки. Многие пигменты неустойчивы к действию кислот или щелочей. Жиры и масла под действием водных растворов щелочей и минеральных кислот омыляются (гидролизуются), то есть разлагаются на глицерин и жирные кислоты или их соли. Белковые клеи (желатина, рыбий клей, казеин) под действием кислот и щелочей подвергаются либо денатурации, либо гидролизу*. Кислоты вызывают разрушение желтковой эмульсии, а также расщепление комплексов жировых и белковых соединений, из которых состоит желток. Крепкие кислоты и щелочи денатурируют белок яйца. Щелочи омыляют (гидролизуют) воски на спирт и соли жирных кислот.
Перед тем как решиться применить тот или иной реставрационный материал (раствор, препарат), реставратор должен заинтересоваться степенью его кислотности или щелочности. Реакцию среды контролируют путем определения рН. В тех случаях, когда это возможно, производят реакцию нейтрализации. При обнаружении высокой активной кислотности — низкого рН — ее нейтрализуют щелочью (основанием). Гидроксильные ионы ОН- основания связывают водородные ионы Н+ с образованием воды Н++ОН 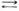 Н2О. При обнаружении значительной активной щелочности — высокого содержания гидроксильных ионов, то есть высокого значения рН — производят реакцию нейтрализации кислотой ОН-+H+
Н2О. При обнаружении значительной активной щелочности — высокого содержания гидроксильных ионов, то есть высокого значения рН — производят реакцию нейтрализации кислотой ОН-+H+ 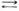 H2O
H2O
__________
* Гидролиз клея выражается в разрушении межмолекулярных и молекулярных связей.
Перед реставрацией рН проверяется по изменению цвета индикатора, обычно по индикаторной бумаге. Бумагу смачивают свежепрокипяченной дистиллированной водой, прикладывают с помощью чистого пинцета к исследуемой поверхности и прижимают чистой стеклянной пластинкой.
ПРОЦЕССЫ УДАЛЕНИЯ ПОВЕРХНОСТНЫХ ЗАГРЯЗНЕНИЙ С ПРОИЗВЕДЕНИИ ЖИВОПИСИ И ПРИМЕНЯЕМЫЕ ПРИ ЭТОМ МАТЕРИАЛЫ
ДИСПЕРСНЫЕ СИСТЕМЫ
Кроме обычных (истинных) растворов, в которых частицы растворенного вещества достигают предельной дисперсности (раздробленности), то есть равны размерам молекул и ионов, в реставрационной практике находят широкое применение такие системы, отдельные частицы которых включают много сотен и тысяч атомов или молекул, имеют свою внутреннюю поверхность раздела со средой, в которой они распределены (но не растворены). Такие системы называются дисперсными системами. Раздробленные вещества называют дисперсной фазой, а среда, в которой распределена дисперсная фаза, носит название дисперсной среды. По степени дисперсности системы делятся на два класса: грубодисперсные (размер частиц от 10-3 до 10-5 см) и коллоиднодисперсные (размер частиц от 10-5 до 10-7 см). По агрегатному состоянию грубодисперсные системы делятся на суспензии, эмульсии, пены и аэрозоли. В суспензиях частицы твердой дисперсной фазы распределены в жидкой дисперсной среде. В эмульсиях мельчайшие капельки жидкой дисперсной фазы распределены в жидкой дисперсной среде. В пенах ячейки (пузырьки), наполненные воздухом или другим газом, отделены друг от друга жидкими пленками. В аэрозолях дисперсной средой является воздух или иной газ, а дисперсной фазой — капельки жидкости или диспергированное твердое вещество.
Эмульсии. Их применение в реставрации живописи. Эмульсии находят применение при удалении загрязнений с поверхности живописи. В процессе расчистки масляной живописи используют следующие составы, дающие эмульсии: вода + пинен + масло (льняное очищенное) + спирт + аммиак (несколько капель нашатырного спирта), вода + масло (льняное) + аммиак (несколько капель нашатырного спирта); а для древней темперной живописи: вода + толуол + ОП-7 (1 часть на 7 частей воды); вода + спирт + подсолнечное масло + аммиак (несколько капель нашатырного спирта). Эмульсии также применяются для укрепления красочного слоя и в качестве связующих для темперных красок: природная эмульсия — яичный желток — и синтетические дисперсии на основе поливинилацетата, полиакрилатов и др.
Различают эмульсии неполярной (или слабо полярной) жидкости в полярной (например, эмульсии масла в воде) — эмульсии первого рода — и эмульсии полярной жидкости в неполярной (например, эмульсия воды в масле) — эмульсии второго рода. Эмульсии первого рода часто обозначают через м/в, где под буквой «м» подразумевается масло или иная неполярная жидкость, а под буквой «в» — вода или иная полярная жидкость. Эмульсии второго рода обозначают соответственно через в/м.
Применяемые для удаления загрязнений с поверхности живописи эмульсии масла, а также толуола в воде относятся к эмульсиям м/в; масло или толуол образуют дисперсную фазу, а вода — дисперсионную среду. В желт-
ке куриного яйца дисперсной фазой являются мельчайшие капельки липидов (жиров), дисперсионной средой — вода. В поливинилацетатной дисперсии частицы поливинилацетата являются дисперсной фазой, а вода — дисперсионной средой.
Эмульсии получаются методом диспергирования двух несмешивающихся жидкостей. Диспергирование производят встряхиванием, взбалтыванием, разбиванием смеси в аппаратах различных конструкций. Взбалтывая, например, 5 мл растительного масла в 50 — 70 мл воды в закрытом цилиндре, получают эмульсию; при этом происходит разбивание масла на крошечные капельки, распределяющиеся в водной среде. Для придания эмульсии устойчивости, требуется ввести в систему третий компонент, понижающий поверхностное натяжение — поверхностно-активное вещество. Этот компонент называется эмульгатором. При малых концентрациях эмульсий можно повысить устойчивость системы, вводя какое-либо поверхностно-активное вещество, способное понизить поверхностное натяжение на поверхности раздела фаз. Например, добавлением бутилового спирта в систему вода — бензол можно несколько уменьшить скорость слияния капель раздробленного бензола. При больших концентрациях эмульсий взвешенные капли очень часто сталкиваются между собой, что приводит к их слиянию. Поэтому в концентрированных эмульсиях эмульгаторами могут быть те поверхностно-активные вещества, которые способны адсорбироваться на поверхности капелек и создавать на них прочную упругую пленку, предохраняющую их от слияния. Такие эмульгаторы сообщают эмульсии высокую устойчивость. Эмульсии м/в стабилизируются растворимыми в воде высокомолекулярными соединениями — белками (желатиной, казеином), поливиниловым спиртом, водорастворимыми мылами (например, натриевым мылом) и др. Эмульсии в/м стабилизируются высокомолекулярными соединениями, растворимыми в углеводородах или мылами кальция, магния.
Применяемый при эмульгировании толуола в воде препарат ОП-7 является поверхностно-активным веществом. В яичном желтке эмульгатором системы м/в является лецитин. Высокая стабильность поливинилацетатной дисперсии обусловлена поливиниловым спиртом. В акрилатных эмульсиях эмульгатором служит некаль.
В эмульсиях, применяемых для удаления загрязнений с произведений живописи, содержатся эмульгаторы — поверхностно-активные вещества. Последние способствуют смачиванию отмываемой поверхности и частиц загрязнений моющим составом, адсорбируются на поверхности частиц и тем самым препятствуют их слиянию и обратному прилипанию к отмываемой поверхности. В этих сложных системах, содержащих воду, органические растворители, масляную фазу и эмульгаторы, одни компоненты избирательно смачивают, а другие растворяют наиболее близкие им по полярности элементы поверхности и загрязняющие частицы.
Моющее действие поверхностно-активных веществ. К моющим веществам относятся мыла и разнообразные сложные по составу синтетические препараты. Под мылами в узком смысле слова подразумевают соли одноосновных, сравнительно высокомолекулярных жирных кислот, обладающие поверхностной активностью. Их принято называть «обычными мылами». Из них особое значение имеют натриевые мыла пальмитиновой, стеариновой и ненасыщенной олеиновой кислот, получаемых из животных жиров. Обычные мыла содержат в себе большое коли-
чество воды, а часто и примеси различных веществ. Для произведений живописи опасна высокая щелочность многих мыл.
Мыло туалетное, выпускаемое согласно МРТУ 18/236-68, представляет собой продукт механической обработки высококачественного ядрового мыла, состоящего, в основном, из натриевых солей жирных (натуральных и синтетических) кислот с добавлением краски и отдушки или без них. Мыло туалетное подразделяется на 80%-ное, детское, I, II и III группы. Из всех сортов туалетного мыла «детское мыло» выгодно отличается меньшим предельным содержанием свободной щелочи — 0,03% против 0,05% у остальных сортов. В первых трех сортах туалетного мыла допускаемое содержание свободной углекислой соды — 0,2%. (Только в «детское мыло» вводятся ланолин или спермацет — 1%, борная кислота — 0,5%.)
Очень часто под мылами понимают все соединения, близкие к мылам по строению молекул и обладающие аналогичными физико-механическими и техническими свойствами. Иногда такие соединения называют также моющими веществами — детергентами.
К моющим средствам, содержащим в качестве активной группы сульфо-группу, следует в первую очередь отнести соли высокомолекулярных сульфокислот. Сюда же относятся соли алкилзамещенных нафталинсульфокислот. Соединения последнего типа получили в технике название некалей.
В качестве моющих средств в настоящее время широко применяют и алкилсульфаты — эфиры серной кислоты с высшими спиртами, а также их соли.
Помимо мыл, молекулы которых диссоциируют (распадаются) на ионы, существуют так называемые неионные мыла, то есть моющие средства с молекулами, не способными к ионизации.
Примером неионных моющих средств являются соединения, получаемые в результате взаимодействия молекулы высокомолекулярного спирта (или алкилфенола) с несколькими молекулами окиси этилена СnH2n+1(ОСН2СН2)m он (к этому типу мыл относится препарат ОП-7, применяемый при эмульгировании толуола в воде).
В настоящее время известны сотни синтетических веществ, обладающих моющими свойствами.
Растворы мыл относятся к полуколлоидным системам. Полуколлоидными называются системы, которые в одних условиях могут представлять собой истинные растворы, — то есть гомогенную систему, содержащую молекулы, а в других — дисперсную систему, частицы которой представляют собой объединение множества молекул. Такие частицы называются мицеллами. Они существуют до тех пор, пока в результате действия внешних факторов не сместится равновесие, в котором пребывала система. В системе, в которой образовались мицеллы, всегда продолжает существовать некоторое количество истинно растворенного вещества дисперсной фазы. С повышением содержания мыла в растворе в системе из отдельных молекул мыла начинает образовываться большое количество мицелл.
Сущность процесса удаления загрязнений с поверхности живописи с помощью растворов мыл. Моющее действие мыл связано с рядом различных эффектов. В присутствии в воде поверхностно-активного мыла понижается поверхностное натяжение на границе вода — очищаемая поверхность и улучшается смачивание этой поверхности моющей жидкостью. Это способствует проникновению жидкости в такие капилляры загрязненной поверхности, такие щели и трещины слипшихся грязевых частиц, в которые
чистая вода проникнуть не может. Молекулы мыла адсорбируются на отмываемой поверхности и частицах твердых и жидких загрязнений, создают на них хорошо гидратированный адсорбционный слой. Все это способствует отрыву частиц загрязнений от поверхности и раздроблению их на мельчайшие отдельные частицы (с образованием эмульсий или суспензий). Адсорбционные пленки на поверхности частиц загрязнений придают этим частицам высокую агрегативную устойчивость, предохраняют их от слипания и не допускают прилипания их к отмываемой поверхности.
Моющее действие в известной степени связано со способностью загрязнений, особенно если они имеют масляный характер, коллоидно растворяться (солюбилизироваться) в мыльных растворах. Солюбилизация представляет собой растворение органических веществ в углеводородной части мицелл, всегда присутствующих в достаточно концентрированных растворах мыл. Количество коллоидно растворенного органического вещества, как правило, возрастает с увеличением молекулярного веса мыла. Количество солюбилизированного вещества зависит от концентрации мыльного раствора.
После отмывки поверхности от загрязнений необходимо тщательно удалить промывкой остатки мыл, так как, оставаясь адсорбированными на отмытой поверхности, они с течением времени могут отрицательно влиять на сохранность живописи.
МАТЕРИАЛЫ, ПРИМЕНЯЕМЫЕ ДЛЯ УДАЛЕНИЯ ЛАКОВЫХ ПОКРЫТИЙ И РАСЧИСТКИ ЖИВОПИСИ
В живописи широко используются органические растворители. Они применяются для приготовления покрывных лаков, разбавления разжижения масляных красок, промывки картин, удаления постаревших защитных лаковых покрытий и для удаления записей.
В распоряжении реставраторов имеются многочисленные растворители или их смеси, которые используются для вышеуказанных целей. Во всех случаях использования органических растворителей приходится считаться со множеством факторов, обусловленных взаимодействием растворителей с материалами произведений, влиянием на человека (токсичностью), требованиями техники безопасности.
Многие органические растворители действуют на белковые клеи (желатину, рыбий клей, белок куриного яйца) денатурирующим образом (понижая их растворимость в воде), вызывают сильное набухание линоксина*, анекоторые (тетралин, циклогексанол) способны его растворять. Особая осторожность нужна при удалении старой олифы и масляных записей с произведений древней темперной живописи, так как лецитин яичного желтка, являющегося связующим веществом темперных красок, хорошо растворим во многих органических растворителях (хлороформе, бензоле, этиловом эфире, этиловом спирте и др.).
ОСНОВНЫЕ ХАРАКТЕРНЫЕ ПОКАЗАТЕЛИ ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЕЙ
Каждый растворитель характеризуется температурой кипения, летучестью, степенью огнеопасности, токсичности, что необходимо учитывать при подборе растворителей и работе с ними.
__________
* Линоксином называют твердые трехмерные нерастворимые и неплавкие полимеры, являющиеся конечным продуктом при «высыхании» масла. Такие масла, как льняное, ореховое, маковое, весьма быстро образуют твердую пленку. Масла этого типа называются «высыхающими». По мере «высыхания» масляной пленки происходит понижение ее растворимости в органических растворителях.
Температура кипения и перегонка (дистилляция) растворителей.Каждая жидкость кипит при вполне определенной постоянной температуре, зависящей от внешнего давления. Обычно имеют в виду температуру, при которой жидкость кипит, находясь поднормальным давлением (одна атмосфера или 760 мм ртутного столба). Температурой кипения называется температура, при которой давление пара жидкости становится равным внешнему давлению.
Когда кипение началось, повышение температуры жидкости прекращается, несмотря на то, что нагревание продолжается. Если жидкость нагревать до кипения и отводить образующиеся пары по трубке, то при их охлаждении на стенках начнется образование капель — конденсация паров. Этим свойством жидкости пользуются для очистки растворителей перегонкой (дистилляцией). Для этой цели служит прибор, состоящий из круглодонной колбы с отводной трубкой, термометра, холодильника и приемника.
Воду, очищенную от растворенных в ней примесей перегонкой, называют дистиллированной*. Когда из смеси растворителей с различными температурами кипения требуется выделить некоторые компоненты, тогда применяют дробную перегонку. При этом в горло колбы с отгоняемой жидкостью вставляется дефлегматор, снабженный термометром. Дробной перегонкой, например, получают головные отгоны скипидара; более тяжелые фракции и нелетучая часть остаются в колбе.
Летучесть растворителей.Удаление растворителей без повышения температуры путем испарения в токе воздуха называется летучестью. Летучесть определяется величиной молекулярного веса растворителя и другими фактора-
__________
* Для перегонки волы пользуются специальными дистилляторами.
ми, в первую очередь его полярностью. Молекулы полярных растворителей в значительной степени ассоциированы, что является причиной относительно малой упругости пара и, следовательно, высокой температуры кипения и малой летучести.
Упругость пара (давление, оказываемое паром, находящимся в равновесии с жидкой или твердой фазой) в определенной степени характеризует летучесть ряда растворителей, например, у этилового спирта при 20° упругость пара 44 мм рт. ст., а у этилового (серного) эфира 442,4 мм рт. ст. Если принять скорость улетучивания капли этилового эфира за 100, то относительная скорость улетучивания этилового спирта будет равна 12 (см. табл. 11).
Летучесть зависит и от величины скрытой теплоты испарения, теплоемкости, теплопроводности и других свойств жидкости. Так, этиловый спирт (температура кипения 78,3°) и вода (100°) улетучиваются при комнатной температуре медленнее, чем толуол (110°). Температуры кипения монометилового эфира этиленгликоля (метилцеллозольва) и бутилацетата очень близки друг к другу (около 125°), но летучесть последнего примерно в 3 раза больше.
Дата добавления: 2016-11-02; просмотров: 1311;
