МЕТОДЫ РАБОТЫ С МИКРООРГАНИЗМАМИ
Приборы, посуда. Инструментом первой необходимости у работающего с микроорганизмами является игла для пересевов. В идеальных случаях она делается из платиновой проволоки. При отсутствии платины иглу можно сделать из стальной проволоки или, что еще лучше, из проволоки, применяемой в электролампах для поддержки светящейся нити. Проволоку длиной 6 — 7 см впаивают в стеклянную палочку или вставляют в специальный (имеется в продаже) иглодержатель. С помощью такой иглы, которая может быть прямой или согнутой под углом, делают пересевы микроорганизмов. В тех случаях, когда требуется сделать перенос взвеси спор или капли жидкого питательного раствора, необходимо иметь под рукой петлю (рис. 20), которая делается из той же иглы путем закручивания ее кончика. Для удобства хорошо иметь набор игл и петель разного диаметра. Нужно иметь также скальпели, пинцеты, ножницы, шпатели.
Наиболее употребимой посудой являются пробирки химические, чашки Петри, колбы
конические, воронки, мензурки, пипетки градуированные, стекла предметные и покровные, колпаки стеклянные, эксикаторы. Посуда, употребляемая для микробиологических работ, должна содержаться вчистоте. Вся-

| 
| 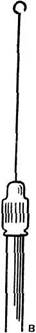
|
| Рис. 20. Петли для посева: А — сделана правильно, Б и В — неправильно |
кое, даже незначительное ее загрязнение будет затруднять работу. Поэтому перед проведением опытов посуду необходимо тщательно вымыть.
Если посуда загрязнена органическими остатками, ее следует замочить в растворе соды или другого моющего средства и оставить на ночь. На следующий день посуду тщательно промыть, а затем погрузить в раствор хромовой смеси (серная кислота + 5% по весу К2Сr2O7). После этого посуду следует прополоскать сначала водопроводной, а потом дистиллированной водой и просушить (на воздухе или в специальном шкафу). Для того чтобы предохранить чистую посуду от повторного попадания микроорганизмов, ее перед стерилизацией закрывают ватными пробками (пробирки, колбы) или обертывают бумагой (чашки Петри, мерные пипетки и проч.).
Большое значение имеет правильное изготовление ватных пробок. Пробка играет роль фильтра, который должен задерживать на себе посторонние микроорганизмы, но не должен затруднять газообмен культуры с окружающей средой. Следовательно, должна быть достаточно, но не чрезмерно плотной. Для изготовления пробок лучше пользоваться негигроскопической ватой, чтобы затруднить ее намокание.
Намокшие пробки становятся хорошей средой для обитания микроорганизмов, чего допускать не следует. Пробки готовят из плоского куска ваты, загибая его края, а затем скатывая валиком. Длина пробки должна быть около 4 см (рис. 21).
Чашки Петри перед стерилизацией завертывают в бумагу. В ней они остаются и на период хранения и на период эксперимента. Бумага предохраняет поверхность чашки от загрязнений, что в свою очередь способствует сохранению чистоты находящейся в ней культуры.
Питательные среды. Для культивирования микробов применяют разнообразные питательные среды, выбирая их с учетом особенностей исследуемых организмов. Наиболее употребительными средами для культивирования бактерий являются мясо-пептонный бульон, мясо-пептонная желатина и мясо-пептонный агар, для культивирования грибов — сусло-агар, среда Чапека и среда Сабуро. Мясо-пептонный бульон может быть приготовлен из мясные кубиков, для чего в 1 л воды растворяют 20 г кубиков и 10 г пептона. В полученный бульон добавляют такое количество 10%-ного раствора соды или едкого натра, чтобы получить слабощелочную
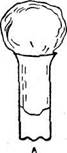
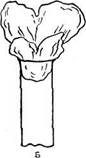
| 
| 
|
| Рис. 21. Ватные пробки: А — изготовлена правильно, Б и В- неправильно |
реакцию бульона (реакцию определяют по лакмусу). После этого бульон разливают и стерилизуют.
Мясо-пептонный агар. Для количественного учета бактерий и выделения их в
чистую культуру применяют плотные среды. Для их получения к питательным растворам добавляют или желатину, или агар-агар. Для получения мясо-пептонного агара в мясо-пептонный бульон добавляют 2% агар-агара и нагревают его для того, чтобы агар-агар растворился. Полученный мясо-пептонный агар часто бывает мутным. Для его осветления можно рекомендовать следующий метод. Налить мясо-пептонный агар в какой-либо высокий сосуд, а потом дать медленно остыть. После этого мясо-пептонный агар (после охлаждения он имеет вид студня) вытряхнуть из сосуда и нижнюю часть, где собрался осадок, обрезать. Прозрачную часть агара снова расплавить, разлить и простерилизовать.
Мясо-пептонная желатина готовится из мясо-пептонного бульона путем добавления в него 10 — 12% желатины. Желатина имеет кислую реакцию, поэтому после ее добавления следует проверить реакцию полученного раствора и в случае надобности довести ее до слабощелочной (проба на лакмусовую бумажку). Для осветления раствора к нему на каждые 500 мл добавляют один яичный белок, раствор взбалтывают и нагревают. Получившийся осадок отфильтровывают, среду разливают, и стерилизация мясо-пептонной желатины проводится текучим паром (см. ниже), так как белковая среда не выносит более высоких температур.
Сусло-агар. Им очень охотно пользуются при работе с плесневыми грибами. Готовят сусло-агар из неохмеленного сусла с добавлением в него 2% агара. Неохмеленное сусло содержит в себе богатый комплекс всех необходимых грибам питательных веществ — углеводы, азотистые вещества и зольные элементы. Перед приготовлением среды в сусле определяют содержание сахара и, если надо, разбавлением водой доводят его содержание до нужного уровня. Обычно для грибов употребляют сусло с содержанием 6 — 8% сахара. Определение проводят с помощью ареометра Баллинга. Обычно для приготовления сусло-агара пользуются готовым пивным суслом, но его нетрудно в случае необходимости приготовить самим. Для этого берут 250 г молотого ячменного солода, заливают литром теплой (48 — 50°С) воды, тщательно перемешивают и затем подогревают до 55°С. Температуру на этом уровне поддерживают до тех пор, пока не произойдет полное осахаривание крахмала (определяют по отсутствию синей окраски от йода). Через некоторое время сусло декантируют от осадка и затем процеживают через холст. Стерилизуют сусло-агар в автоклаве (30 мин при 120°С).
Среда Чапека. Очень часто грибы культивируют на среде Чапека. Среда Чапека является синтетической питательной средой, состоящей из комплекса минеральных солей и сахарозы:
Сахароза — 30,0 г
NaNO3 — 3,0 г
KH2PO4 — 1,0 г
MgSO4.7H2O — 0,5 г
FeSO4 — 0,01 г
Вода — 1000 мл.
Среда Сабуро
Глюкоза — 40 г
Пептон — 10 г
Вода — 1000 мл.
Общим правилом при работе с любой питательной средой является необходимость соблюдения аккуратности при разливке. Если питательная среда попадет на край пробирки или чашки, то это грозит заражением культуры. Разливку среды по пробиркам лучше всего проводить через воронку или бюретку.
Методы стерилизации.Инструменты, посуда, питательные среды, которые применяются для работы с микроорганизмами, должны быть стерильными. Стерилизация, в зависимости от свойств предмета, может быть достигнута различными методами. В лабораторной практике чаще всего применяется стерилизация нагреванием.
Стеклянную посуду стерилизуют сухим жаром. С этой целью используют сушильный шкафы с нагревом до 200°С. Перед стерилизацией чашки Петри завертывают в бумагу, а пробирки закрывают ватными пробками (см. выше). Стерилизация сухим жаром проводится в течение часа при температуре 150°С. Нагревания свыше 170°С не производят, так как при такой температуре бумага и вата начинают буреть и обугливаться.
Часто приходится стерилизовать различные мелкие лабораторные предметы. Если они переносят нагревание над пламенем горелки, то пользуются им. Так обычно стерилизуют платиновые иглы, пинцеты и другие предметы.
Питательные среды обычно стерилизуют нагретым паром. При этом различают два типа стерилизации: 1) текучим паром и 2) насыщенным паром при повышенном давлении.
Стерилизация текучим паром производится в тех случаях, когда стерилизуемые среды не выносят высоких температур. Эта процедура проводится в так называемом кипятильнике Коха, представляющем собой цилиндрический сосуд из оцинкованной жести, обшитый снаружи теплоизоляционным материа-
лом. На дно сосуда наливается вода, а стерилизуемый материал помещается над ней в специальном ведерке; сосуд закрывается сверху плотной конической крышкой. Под кипятильником помещают нагревательный прибор. Время стерилизации отсчитывают с момента энергичного выделения пара. Стерилизацию проводят в течение трех дней подряд, по полчаса ежедневно. Иногда перерыв между второй и третьей стерилизацией удлиняют до 48 часов.
Смысл этого метода стерилизации заключается в следующем. Температура воды (а следовательно, и пара), кипящей при нормальном атмосферном давлении, не будет превышать 100°. Этой температуры достаточно, чтобы убить вегетативные клетки микроорганизмов, но споры от такой температуры не погибают. Считается, что в течение суток, проходящих между процессами стерилизации, они должны прорасти в молодые вегетативные клетки, чувствительные к повышенным температурам. Следующим этапом стерилизации достигается их гибель.
Стерилизация насыщенным паром под давлением производится в специальном котле — автоклаве. Создаваемое паром внутри котла давление дает возможность проводить нагревание при температуре выше 100°. При давлении пара в одну атмосферу (по манометру) температура кипения воды равна 120°С. Время стерилизации при этом методе сокращается до 30 мин.
Работать с автоклавом должны только квалифицированные лица, так как неправильное обращение с ним может привести к взрыву (следует помнить, что автоклав работает при высоком давлении).
Методы холодной стерилизации применяют в тех случаях, когда среды не выдерживают нагревания (белковые среды, сыворотки и т. д.). Для этой цели применяют различные мелкопористые фильтры (асбестовые, фарфоровые). Наибольшее распространение получили фильтры Зейтца (рис. 22) с асбестовой пластинкой. Фильтр вставляют в колбу Бунзена и присоединяют к вакуумному насосу, так как фильтрование должно происходить при разреженном давлении. Весь прибор перед работой должен быть простерилизован. Смысл этого метода заключается в адсорбции фильтром всех мелких частиц, в том числе и микроорганизмов.
После стерилизации (каким бы методом она ни проводилась) среды выдерживают для проверки стерильности трое суток в термостате при температуре 25 — 27°. Отсутствие роста на средах говорит о их стерильности. В противном случае среда не годится для употребления и должна быть приготовлена заново.
Изолирование и культивирование микроорганизмов. Для изучения морфологии и физиологических особенностей микроба его необходимо выделить (изолировать) из природной среды, в которой он находится в сообществе
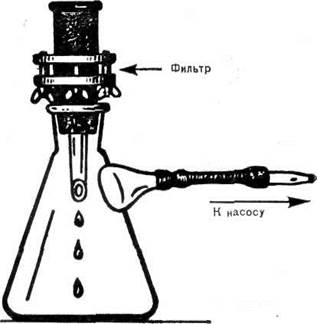
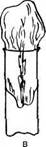
|
| Рис. 22. Фильтр Зейтца |
с другими организмами, в чистую культуру. Чистая культура представляет собой только один вид микроорганизма.
Культивировать микроорганизмы — это значит искусственно создавать условия для их роста. Для этого необходимо с учетом особенностей микроорганизма подобрать подходящую для него питательную среду. В микробиологической практике используют самые разнообразные по консистенции и составу питательные среды. Наиболее употребительными из них являются описанные выше мясо-пептонные среды и сусло-агар.
Аппаратура, посуда и среды, предназначенные для выделения чистой культуры, должны быть предварительно простерилизованы. Поверхность стола, на котором проводятся работы, должна быть гладкой, из материала, допускающего обработку дезинфицирующими растворами. Дезинфекцию поверхности стола следует проводить каждый раз перед началом работы. Одним из обязательных приборов является горелка, на которой обжигают все предметы, входящие в контакт с микроорганизмами.
Перед открыванием пробирки с питательной средой ватная пробка, закрывающая ее, должна быть обожжена. Этим достигается
уничтожение микробов, попавших на ее поверхность, а следовательно, предупреждается заражение культуры. Пробку надо извлекать плавно, осторожно выкручивая ее из пробирки. Пробирки во время пересевов надо держать вертикально, отверстием вниз, или горизонтально, если среда жидкая. Извлеченную пробку держат между пальцами правой руки таким образом, чтобы часть ее, бывшая внутри пробирки, не касалась руки. Горло пробирки слегка обжигают и уже после этого вносят обожженной иглой посевной материал, касаясь им поверхности питательной среды. Игла обжигается до и после посевов. Открывание посуды с питательными средами следует осторожно проводить около пламени горелки, не вызывая при этом резкого движения воздуха.
Чашки Петри ставят или на стерильную поверхность стола или оставляют их на бумаге, в которой они стерилизовались. Открывают их в направлении пламени горелки, слегка приподняв с одной стороны крышку так, чтобы можно было вылить в них содержимое пробирок или внести иглой исследуемый материал.
Существует много методов изолирования микроорганизмов в чистую культуру. Здесь приведены два метода, которые пригодны и для выделения грибов и для выделения бактерий*.
Метод разливки. Берут несколько пробирок с расплавленной и остуженной питательной средой. В одну из них, соблюдая все правила предосторожности, описанные выше, вносят иглой посевной материал. Пробирку закрывают ватной пробкой и осторожно встряхивают, добиваясь равномерного распределения посевного материала в питательной среде. После этого, взяв другую пробирку, переносят в нее петлей из первой пробирки небольшое количество питательной среды. Пробирку, как и в первом случае, покачивают или встряхивают, после чего снова переносят одну-две петли с питательной средой в третью пробирку. Так поступают четыре, пять раз. В результате получают ряд пробирок, содержащих разный по концентрации посевной материал. Содержимое каждой из пробирок переливают в стерильные чашки Петри и, покачивая последние, добиваются равномерного распределения в них питательной среды. После остывания питательной среды чашки ставят в термостат. Температура в термостате задается в зависимости от того, какую группу микроорганизмов необходимо
__________
* Метод выделения и культивирования анаэробных микроорганизмов здесь не рассматривается, так как в музейной практике они, по-видимому, не встречаются.
вырастить. Если это бактерии, то температура должна быть 30 — 35°С, если плесневые грибы, то 25 — 27°С.
Чашки с агаровыми средами ставят в термостат вверх дном. С желатиновыми средами так поступать нельзя, так как некоторые микроорганизмы вызывают их разжижение. Все работы с агаровыми средами должны проводиться быстро, поскольку агар очень быстро застывает. По прошествии 2 — 3 дней в чашках образуются колонии микроорганизмов. Если размешивание питательной среды было тщательным, то можно считать, что каждая колония образовалась из одной клетки. Чистота культуры должна быть проверена под микроскопом и повторным посевом на питательную среду. Однородность полученных при этом колоний будет подтверждением чистоты культуры.
Метод поверхностного посева. В чашки Петри разливают агаровую или желатиновую среду и дают ей застыть. На поверхность среды наносят небольшое количества исследуемого материала и растирают шпателем, сделанным из стеклянной палочки, по поверхности среды. Затем этим же шпателем проводят по поверхности питательной среды во второй и третьей чашках. Чашки ставят в термостат, перевернув их вверх дном. Количество выросших микроорганизмов будет уменьшаться соответственно от первой чашки к последней. Из них выбирают ту, в которой колонии выросли обособленно друг от друга.
Выделение в чистую культуру проводят следующим образом. Прокаленной и остуженной иглой прикасаются к колонии и переносят прилипшие к игле клетки в пробирку с питательной средой. Пробирки помещают в термостат. Через несколько суток в пробирках разовьется чистая культура. Обычно для культивирования микроба в пробирках пользуются плотной, застывшей под углом питательной средой. Для получения таких косячков пробирки с незастывшей еще средой кладут под углом к поверхности стола, подкладывая под них какой-либо предмет.
2. НАСЕКОМЫЕ
Насекомые — один из классов животного мира, который относится к типу членистоногих.
По количеству видов класс насекомых самый многочисленный; в настоящее время он насчитывает около одного миллиона видов.
Среди насекомых есть полезные. Однако большинство насекомых является вредителями, приносящими огромные убытки человеку. Немалый вред причиняют насекомые и музейным коллекциям. Музейные экспонаты за небольшим исключением (металл, керамика, стекло) состоят из материалов органического происхождения и при неправильном хранении могут быть повреждены различными видами насекомых.
Насекомые попадают в музей различными путями: через открытые или незащищенные стеклом или сетками окна, через двери. Источником появления насекомых могут служить вновь поступившие в музей зараженные экспонаты или тара, в которой они были доставлены. Постоянной резервацией появления вредных насекомых могут быть гнездилища голубей в чердачных помещениях музея или в близлежащих помещениях. Во многих случаях деятельность насекомых-вредителей приводит к значительному разрушению музейных экспонатов.
Чтобы выбрать правильные методы борьбы с насекомыми, необходимо знать их видовую принадлежность, так как без определения вида невозможно указать места выплода, а значит, и метод борьбы. Более того, неправильный метод борьбы, без учета особенностей биологии насекомых, может привести не к уничтожению вредителей, а к увеличению их количества. Поэтому рекомендовать эффективные меры борьбы можно только после определения вида насекомого.
ОБЩИЕ СВЕДЕНИЯ О НАСЕКОМЫХ
Внешнее строение насекомых. Тело насекомых состоит из трех отделов: головы, груди и брюшка.
Голова насекомых состоит из шести сросшихся сегментов; на голове расположены глаза, антенны или усики, и ротовой аппарат. Исходным типом ротового аппарата является грызущий. Такой тип ротового аппарата имеют жуки и некоторые другие насекомые. У бабочек — сосущий ротовой аппарат, у комнатной мухи — лижущий. К грудным членикам прикрепляются ноги и крылья. Каждый членик груди несет по паре ног. Крылья расположены по бокам груди. Обычно у насекомых бывают две пары крыльев, но бывает и одна пара или крылья вовсе отсутствуют. У жуков верхняя пара крыльев называется надкрыльями.
Брюшко имеет различное число члеников. Кожный покров насекомых состоит из мягкого внутреннего слоя (гиподерма) и твердого наружного слоя (кутикула). Кутикула имеет сложное строение и устойчива к различным химическим воздействиям.
У насекомых имеется мускулатура, органы пищеварения, выделения и дыхания, кровеносная и нервная системы, органы размножения.
Размножение и развитие. Насекомые размножаются половым путем. Различают два вида полового размножения — когда яйца оплодотворяются сперматозоидами (мужскими клетками) и когда зародыш развивается из неоплодотворенного яйца. Это девственный способ размножения, или партеногенез.
Весь цикл развития насекомых разделяется на эмбриональное (внутри яйца) развитие и постэмбриональное. Развитие зародыша в яйце продолжается от нескольких дней до одного месяца. Постэмбриональное развитие начинается после вылупления личинки и продолжается от нескольких дней до нескольких лет. Личинки в процессе своего развития питаются ирастут, причем рост сопровождается линьками, когда сбрасывается старая кутикула. Количество линек у различных насекомых различно. Необходимо учесть, что
перелинявшая личинка наиболее уязвима, так как некоторое время ее покров очень нежен и легко пропускает газы и другие химические вещества. Последнее очень важно при выборе времени и определении тех или иных мер борьбы.
В процессе своего развития насекомые претерпевают ряд изменений. Совокупность этих изменений называется превращением, или метаморфозом. По характеру и особенностям метаморфоза насекомые разделяются на две группы: насекомые с неполным превращением и насекомые с полным превращением. Насекомые с неполным превращением имеют три фазы развития: яйцо, личинку и взрослое насекомое. Причем личинка очень похожа на взрослое насекомое. Насекомые с полным превращением имеют четыре фазы развития: яйцо, личинку, куколку, взрослое насекомое. Здесь личинки резко отличаются от взрослого насекомого (например, бабочка и ее личинка — гусеница).
Личинка линяет несколько раз. С последней линькой она превращается в куколку — стадию покоя. Через некоторое время из куколки выходит взрослое насекомое, которое некоторое время остается неподвижным. За это время нежный кожный покров насекомого постепенно затвердевает и окрашивается, крылья расправляются.
Насекомое во взрослой фазе неспособно к росту и не линяет. Основная функция взрослого насекомого — размножение. Некоторые насекомые после превращения во взрослую фазу имеют вполне развитые половые органы. Эти насекомые не питаются и живут очень недолго. Например, точильщики и моли.
Другая группа насекомых после перехода во взрослую стадию имеет недоразвитые половые органы. Эти насекомые должны иметь дополнительное питание, прежде чем они начнут откладывать яйца. Например, жуки-кожееды питаются пыльцой и нектаром зонтичных растений.
Период развития насекомых от яйца до половозрелого состояния называется жизненным циклом, генерацией или поколением. Продолжительность генерации у различных насекомых различна. Например, ветчинный кожеед имеет одно поколение в году, а хлебный точильщик при определенных условиях может иметь до четырех поколений в год.
МЕТОДЫ И СРЕДСТВА БОРЬБЫ С НАСЕКОМЫМИ
Борьба с насекомыми-вредителями (дезинсекция) ведется по линии профилактических мероприятий и истребительных мер. Профилактические мероприятия — это создание неблагоприятных условий для жизни и размножения насекомых. Истребительные меры — это уничтожение тем или иным способом уже появившихся вредителей.
Для выявления попавших в музей насекомых следует регулярно проводить тщательный осмотр всех помещений. В южных районах страны обследование начинают в апреле, в средних широтах — в мае, а на севере — в июне. Указанное время является периодом наибольшей активности насекомых. Осмотр начинается с окон, так как многие насекомые светолюбивы. Осматривают также пол около окон, плинтусы, пол под стеллажами и шкафами. Затем переходят к осмотру отдельных экспонатов. Осмотру подлежит и само здание музея, особенно если оно деревянное; следует просмотреть чердачное помещение и подвал. Все, что обнаружено при обследовании (живые насекомые или их остатки — шкурки, личинки, куколки), собирается в пробирки. Точный анализ проб и определение насекомых проводятся в лаборатории,
куда следует переслать собранный материал*.
В помещениях музеев следует 1 — 2 раза в год проводить генеральную уборку, так как вредители более интенсивно размножаются в грязных хранилищах: в клубках пыли всегда можно найти яйца, шкурки и даже личинки вредных насекомых. Необходимо вставлять в окна металлические сетки или, в крайнем случае, закрыть их накрахмаленной марлей. Это в значительной мере предупреждает залет насекомых извне.
Профилактические мероприятия предупреждают появление насекомых в музеях. Если же насекомые появились в музее, следует применить истребительные меры борьбы — дезинсекцию. Истребительные меры борьбы подразделяются на механические, физические и химические.
Механические способы борьбы чаще применяются не самостоятельно, а в совокупности с другими методами — физическими или химическими. К механическим методам относится, например, ручной сбор насекомых с последующим их уничтожением.
Физические методы борьбы заключаются в применении термической обработки в виде высоких и низких температур. Температура свыше +40°С губительно действует на все фазы развития насекомых. Низкие температуры могут быть использованы против теплолюбивых точильщиков, однако кратковременное понижение температуры до —10°С не вызывает гибели отдельных фаз насекомых. При термической обработке следует учитывать возможность подвергать обрабатываемый объект температурному воздействию.
__________
* При сборе насекомых и их пересылке можно руководствоваться "Временной инструкцией по сбору насекомых, повреждающих музейные экспонаты» (см. «Информационные материалы для работников реставрационных мастерских и музеев». М., ВЦНИЛКР, 1966).
Химические методы борьбы состоят в применении с целью уничтожения насекомых химических веществ, называемых инсектицидами*. В зависимости от способа попадания в организм насекомого инсектициды делятся на три группы: контактные яды, яды кишечного действия и фумиганты.
К инсектицидам контактного действия относятся яды, проникающие в органы насекомого при соприкосновении, через наружные покровы. Это скипидар, пиретрум, ДДТ, гексахлоран, хлорофос и другие.
Кишечные яды — инсектициды, проникающие в организм насекомого с отравленной пищей, водой, К ним относятся все мышьяковистые соединения, кремнефтористый натрий, хлорофос и ДДТ в пищевых приманках,
Фумиганты действуют на насекомых через дыхательную систему. К ним относится газ хлорпикрин, синильная кислота (циан), бромистый метил, парадихлорбензол, хлороформ и др. Ядовитые газы для борьбы с насекомыми в музеях применяются редко, так как для этого требуется специальная аппаратура (дезинсекционная камера) и квалифицированный персонал, что не всегда доступно, особенно периферийным музеям.
Формы применения инсектицидов.Инсектициды применяются в виде растворов, суспензий, дустов, порошков, аэрозолей.
Растворы. Инсектициды ДДТ и гексахлоран хорошо растворяются в органических растворителях: уайт-спирите, скипидаре, спирте, дихлорэтане. Хлорофос хорошо растворяется в воде. Растворы в органических растворителях используют или в чистом виде, или их разбавляют водой, и тогда получаются эмульсии.
__________
* От двух латинских слов insectum — насекомые и cido — убиваю.
Суспензии. Водные суспензии получают смешиванием тонко измельченного химического препарата или дуста с водой. В суспензии порошок находится во взвешенном состоянии.
Порошки и дусты. Инсектицидный порошок представляет собой тонко размолотый препарат без добавления наполнителя (пиретрум). Дуст — это препарат, смешанный с инертным порошковым наполнителем. Например, дуст ДДТ — представляет собой препарат ДДТ+наполнитель (каолин, зола, тальк и др.).
Аэрозоли. Их получают путем распыления растворов препарата, испарения препаратов или сжигания горючих материалов, содержащих инсектицид.
Характеристика важнейших инсектицидов. Скипидар — продукт сухой перегонки хвойных пород деревьев. Очищенный скипидар почти бесцветен, прозрачен, со специфическим запахом. Чистый скипидар не оставляет пятен и быстро выветривается.
В воде скипидар не растворяется. Растворяется в спирте, хлороформе, сероуглероде. Применяется чаще в сочетании с другими инсектицидами (например, с ДДТ).
Пиретрум — инсектицид растительного происхождения, практически не токсичен для человека. Порошок пиретрума получают в результате размола цветов кавказской ромашки, содержащей ядовитые вещества, называемые пиретринами. Хранить пиретрум следует в сухом, прохладном и темном месте.
ДДТ — 4,4 - дихлордифенилтрихлорэтан. Для практических целей используется технический ДДТ — твердое вещество желтовато-серого цвета. Обладает слабым фруктовым запахом. ДДТ нерастворим в воде. Растворяется в органических растворителях (спирте, ацетоне, ксилоле, скипидаре и др.). Ядовит для человека и животных.
Гексахлоран — С6Н6С6 — гексахлорциклогексан (ГХЦГ). В практике применяется технический препарат, представляющий собой кристаллический, жирный на ощупь порошок светло-коричневого цвета. Не растворяется в воде. Хорошо растворяется в органических растворителях: ацетоне, спирте, толуоле, серном эфире, бензоле и др. Гексахлоран имеет неприятный запах. Ядовит для человека и животных.
Хлорофос — СН4О4С3Р — 0,0-ди-метил-2,2,2-трихлор-1-оксиэтилфосфонат — представляет собой кристаллическое вещество без цвета и запаха. Хлорофос растворяется в воде при температуре 20° до 15%; хорошо растворяется в органических растворителях. Технический хлорофос имеет вид парафина или густого меда и смешивается с водой в любых соотношениях; имеет кислую реакцию.
Бромистый метил — при комнатной температуре является газом. Заводской продукт — бесцветная прозрачная жидкость. Пары хорошо проникают в пористые предметы. Является универсальным ядом для всех фаз развития насекомых, хорошо растворяется в спиртах, эфирах и других органических растворителях. Жидкий бромистый метил хорошо растворяет жиры, смолы, каучук, краски, лаки.
Парадихлорбензол — белый-кристаллический порошок с приятным запахом. Не горит и химически не активен. В воде не растворяется, но хорошо растворяется в органических растворителях. Ядовит для насекомых, остающихся в парах парадихлорбензола продолжительное время.
Приготовление рабочих растворов, суспензий и контактных смесей. В продаже всегда можно найти готовые препараты ДДТ, ГХЦГ, хлорофос и др. Однако их концентрация не всегда бывает такой, какая нужна для дезинсекции. Ниже приведена таблица, по ко-
торой можно рассчитать, какое количество имеющегося в продаже препарата надо взять для приготовления одного литра рабочей эмульсии или суспензии требуемой концентрации (см. табл. 8).
Допустим, что в нашем распоряжении есть 15%-ный препарат ГХЦГ. Для того чтобы получить один литр
Таблица 8
Дата добавления: 2016-11-02; просмотров: 939;
