Структурные полисахариды злаковых культур
В зерне злаковых культур одну из основных частей зерновки являются семенные и плодовые оболочки, которые в основном состоят из некрахмальных полисахаридов – целлюлоза, гемицеллюлоза, пектиновые вещества, а так же белка, низкомолекулярных органических веществ и минеральных элементов. Эти вещества создают прочность и жесткость клеточных стенок. Для их частичной или полной деструкции существует много способов – механический, химический и биохимический.
Механический способ деструкции является наиболее простым, но одновременно сильное механическое воздействие может привести к изменению структуры сырья на молекулярном уровне, т.е. надо контролировать температурные режимы.
Химический способ деструкции применяется для разделения комплекса структурных полимеров путем преимущественной экстракции какого-либо компонента, а также для расщепления растительных полимеров на низкомолекулярные продукты. Недостатком химической деструкции растительных полимеров является образование побочных продуктов, обладающих токсическими свойствами (метанол, формальдегид, ацетон, летучие фенолы, фурфурол и т.д.) [94].
Биоконверсия растительных полимеров осуществляется путем многоступенчатого превращения субстрата в конечные продукты с участием нескольких ферментов или ферментных систем. Основные группы ферментов используемых для биоконверсии зернового сырья – цитолитические (целлюлаза, гемицеллюлаза, пектолетические), протеолетические и амилолетические [53]..
Ферментные препараты целлюлолитического действия содержат в своем составе ферменты, расщепляющие клеточные стенки: - гидролазы (эндоглюканазы, экзоглюканазы и глюкозидазы), а также окислительные и пектолитические ферменты. Эти ферменты осуществляют процесс мацерации структур клеточных стенок, который заключается в разрушении межмолекулярных связей между основными структурами комплекса клеточных стенок и в частичной фрагментации самих полимеров, что обеспечивает их солюбилизацию (высвобождение) и сопровождается образованием поли - и олигосахаридов. В дальнейшем происходит процесс деградации солюбилизованных молекул с образованием ди - и моносахаридов [259, 339].
По мнению Н.А. Родионовой (1999), первыми на клеточную стенку оболочек зерна действуют пектолитические ферменты и модифицируют ее так, что после их воздействия другие полисахариды становятся доступными ферментам. При расщеплении пектиновых мостиков, связывающих покрытые гемицеллюлозами слои целлюлозы, в первичной клеточной стенке микрофибриллы целлюлозы освобождаются от связи со стенкой, ослабевают или разрушаются связи между целлюлозой и гемицеллюлозами [258, 259].
Высокоупорядоченная целлюлоза расщепляется при синергическом взаимодействии эндоглюканаз и целлобиогидролаз. При действии пектиназ освобождаются лигниноуглеводные комплексы, расщепляющиеся эндоглюканазами [82, 105, 258, 259, 387].
Эндоглюканазам принадлежит важнейшая роль в действии полиферментных систем, поскольку они первыми атакуют целлюлозу. Характерными свойствами эндоглюканаз является абсолютная специфичность к конфигурации расщепляемой гликозидной связи, неспособность гидролизовать полисахариды, содержащие обьёмный заместитель у атома углерода С-6, а также дисахариды. Следует отметить возможность расщепления 1,3-и 1,6-гликозидных связей, чередующихся с 1,4-связью. В качестве низкомолекулярных продуктов действия эндоглюканаз могут образовываться моно-, ди- и трисахариды. Оптимум действия эндоглюканаз составляет рН 4,0-5,5. Для эндоглюканаз характерно возрастание скорости каталитического расщепления олигосахаридов от димеров до гекса- или гептамеров. Целлобиогидролазы отщепляют целлобиозу (основной продукт) и глюкозу (минорный продукт) в процессе гидролиза целлюлозы или целлоолигосахаридов. Гидролиз гликозидной связи происходит с обращением аномерной конфигурации аглюкона невосстанавливающего конца целлюлозы или её фрагментов.
В настоящее время “базовой” моделью действия целлюлазного комплекса является:
Целлюлоза 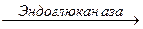 Целлодекстрины
Целлодекстрины 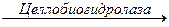 Цел-лобиоза
Цел-лобиоза 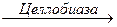 Глюкоза
Глюкоза
Эндоглюканаза гидролизует целлюлозу, осуществляя её деполимеризацию, диспергирование и в определенной степени разрушение кристаллической структуры. Одновременно происходит подготовка субстрата для действия целлобиогидролазы. Оба этих фермента в качестве растворимого продукта дают целлобиозу, которая под действием β-глюкозидазы (целлобиазы) гидролизуется до глюкозы. Целлобиогидролаза может гидролизовать целлюлозу с любой степенью полимеризации. Предполагается, что субстратом для целлобиогидролазы могут служить лишь молекулы с небольшой степенью полимеризации. Глюкоза и целлобиоза могут образовываться под действием эндоглюканазы и целлобиогидролазы[231, 232]. .
Целлобиогидролазы являются специфичными ферментами к β-1,4-гликозидной связи. Серия каталитических актов разрыва гликозидной связи может продолжаться лишь до появления первого карбоксиметильного заместителя, что сопровождается незначительным образованием восстанавливающих сахаров и сохранением неизменной вязкости раствора.. Целлобиогидролазы ингибируются целлобиозой, а иногда глюкозой. Оптимум действия целлобиогидролаз лежит в кислой области, это же характерно и для изоэлектрической точки.
Основным продуктом действия экзоглюкозидаз являются моносахариды. Экзоглюкозидаза обладает способностью гидролизовать до глюкозы аморфную целлюлозу, n-нитрофенил, β-D-глюкозид, целлобиозу, целлотриозу, целлотетраозу и целлопентаозу.
Для глюкозидаз характерна широкая специфичность: они способны гидролизовать D-гликозидные связи между глюкозными и арильными, алкильными или углеводными остатками. β-глюкозидазы могут гидролизовать 1→2,1→3,1→4 и 1→6 гликозидные связи. У многих β - глюкозидаз отсутствует строгая специфичность к конфигурации гидроксильных групп у С-4 и С-5 атомов гексозидов и пентозидов. Гомогенные глюкозидазы делятся на 3 типа: β -глюкозидазы, гидролизующие дисахариды, глюконовые и аглюконовые части которых представлены одинаковыми сахаридными остатками (целлобиаза); арил-глюкозидазы, гидролизующие только глюкозиды, глюконами которых являются ариловые спирты (арил-в-D-глюкозидаза ); β-глюкозидазы, обладающие широкой специфичностью к аглюкону и гидролизующие дисахариды, арилглюкозиды, олигосахариды. Основные отличия в свойствах β-глюкозидаз и экзоглюкозидаз заключаются в том , что первые быстрее гидролизуют более короткие олигосахариды, чем длинные, а также сохраняют аномерную конфигурацию расщепляемой связи; вторые быстрее гидролизуют более длинные олигосахариды, причем гидролиз сопровождается инверсией гликозидной связи. рН-оптимум действия β -глюкозидаз находится в слабокислой или нейтральной области [233, 259].
Глубокий гидролиз целлюлозы осуществляется в результате согласованного действия полиферментной системы, состоящий из эндо- и экзодеполимераз и β -глюкозидаз. В настоящее время “базовой” моделью действия целлюлазного комплекса является следующая: эндоглюканаза гидролизует целлюлозу, осуществляя её деполимеризацию, диспергирование и в определенной степени разрушение кристаллической структуры. Одновременно происходит подготовка субстрата для действия целлобиогидролазы. Оба этих фермента в качестве растворимого продукта дают целлобиозу, которая под действием β-глюкозидазы (целлобиазы) гидролизуется до глюкозы. Глюкоза и целлобиоза могут образовываться под действием эндоглюканазы и целлобиогидралазы из целлоолигосахаридов.
Мягкий гидролиз целлюлозного комплекса может привести к изменению кристаллической структуры целлюлозы, переход ее в аморфное состаяние и к увеличению содержания слизистых веществ за счет гидролиза гемицеллюлоз.
Важнейшим запасным полисахаридом злаковых культур является крахмал. Крахмал является гомополимером глюкозы, он представлен двумя разновидностями полимеров – линейной (амилоза) и разветвленной (амилопектин).
Водные суспензии крахмала при нагревании клейстеризуются, т.е. образуют однородные вязкие коллоидные растворы, в которых вода находится в связанном состоянии. Различные виды крахмала имеют разную температуру клейстеризации. Повышение относительного содержания амилопектина приводит к снижению температуры клейстеризации.
Группа ферментов, гидролизующих крахмал (амилолитических), включает: α-амилазу, β-амилазу, глюкоамилазу, α-глюкозидазу, изоамилазу, пуллуланазу. Для расщепления крахмала с образованием циклизованных продуктов реакции используют фермент циклодекстринглюканотрансферазу, относящуюся к классу трансфераз. Ферменты могут воздействовать как на клейстеризованный, так и на нативный крахмал, но во втором случае реакция протекает значительно медленнее [42, 67, 85].
Действие α-амилазы (α-1,4-глюкан-4-глюканогидролаза) на крахмал характеризуется быстрым снижением вязкости раствора и молекулярной массы олигосахаридов. Гидролизу подвергаются олигосахариды, содержащие не менее 3 глюкозных единиц. При гидролизе амилопектина в продуктах гидролиза, наряду с олигосахаридами линейного строения, присутствуют α-декстрины. α-амилазы условно делят на 2 группы – разжижающего и осахаривающего действия. Первые расщепляют в растворимом крахмале и амилозе не более 40 % гликозидных связей, вторые – до 60 %. Большинство исследованных амилаз проявляют активность в слабокислой и нейтральной среде. Бактериальная α-амилаза имеет оптимум при рН около 6. Кислые амилазы имеют оптимум при рН 2-4. Амилазы микроскопических грибов имеют оптимум при рН от 4 до 5. Оптимальная температура для действия α-амилазы мезофильных штаммов микроорганизмов обычно не превышает 70 °С. Амилазы грибов имеют оптимум при 45-60 °С. Термофильные бактерии могут синтезировать фермент с оптимумом 85-91 °С. α-амилаза принадлежит к числу ферментов с достаточно высокой термостабильностью [66, 87, 178].
β-амилаза (α-1,4-глюкан-мальтогидролаза) – фермент экзо-типа, катализирующей последовательное отщепление мальтозы от нередуцирующего конца молекул амилозы, амилопектина, амилодекстринов. Фермент расщепляет в крахмале только α-1,4-гликозидные связи. Зерновые β-амилазы наиболее активны при рН 4-6, стабильны при рН 4-8. Оптимальная температура действия 40-50 °С, температура стабильности – не выше 60 °С. Зерновые β-амилазы – сульфгидрильные ферменты, их активность подавляют тяжелые металлы и окислительные агенты. В результате гидролиза крахмала образуется 54-58 % мальтозы и 42-46 % предельных декстринов. Мальтоза при отщеплении переходит в β-форму [42, 67, 85, 87].
Глюкоамилаза (α-1,4-глюкан-глюкогидролаза) – экзо-фермент, катализирующий отщепление β-глюкозы от нередуцирующего конца амилозы и амилопектина. Глюкоамилаза расщепляет α-1,4, α-1,6 и α-1,3-гликозидные связи, с наибольшей скоростью - α-1,4. Грибные глюкоамилазы проявляют активность при рН 4,3-5,9 и температуре 40-70 °С. Глюкоамилазы имеют низкую термостабильность [42, 67, 80, 85].
α-глюкозидаза (α-D-глюкозид-глюкогидролаза, мальтаза) является экзо-ферментом. Глюкозидаза гидролизует α-1,4-связи на нередуцирующем конце α-1,4-глюканов, отщепляя глюкозу в α-форме. Субстратами α-глюкозидазы могут служить мальтоза, мальтоолигосахариды, сахароза, амилодекстрины, амилоза, амилопектин, гликоген. В отличие от глюкоамилазы, мальтаза предпочтительно гидролизует низкомолекулярные субстраты [67, 80].
Максимальная активность проявляется у бактериальных глюкозидаз при рН 6-7, у большинства грибных – при рН 3-6. Оптимальная температура для действия фермента 35-55 °С [67, 85, 178].
Пуллуланаза (пуллулан-6-глюканогидролаза) гидролизует α-1,6-гликозидные связи в пуллулане, гликогене, амилопектине и предельных декстринах, образующихся при действии на амилопектин α- и β-амилаз. Основной продукт расщепления пуллулана – мальтотриоза. Проявляет максимальную активность при рН 5-7, некоторые штаммы бациллы продуцируют щелочную пуллуланазу с оптимумо действия при рН 8,5-9. Оптимальная температура – 45-60 °С. Стабильность пуллуланаз повышается в присутствии ионов кальция. Наряду с другими амилолитическими ферментами применяется в технологии сахаристых продуктов, получаемых из крахмала [156].
Изоамилаза (гликоген-6-глюканогидролаза) гидролизует α-1,6-гликозидные связи в ветвящихся субстратах, за исключением пуллулана. Фермент наиболее активен при рН 3-6 и температуре 25-50 °С [32, 67].
К основным структурным компонентам, входящих в состав растительного сырья, помимо перечисленных, относятся также белки и липиды. Белок и пептиды расщепляют ферменты, объединенные в подкласс пептидгидролаз (протеаз). К ним относятся эндопептидазы (протеиназы) – сериновые, тиоловые, карбоксильные, металлсодержащие – и экзопептидазы (пептидазы) – аминопептидазы, дипептидазы, дипептидилпептидазы, пептидилдипептидазы. К ферментам, расщепляющим липиды, относят липазы (триацилглицеролацилгидролазы) [67, 209].
Таким образом, литературные данные свидетельствуют о том, что в преобразовании структурных компонентов растительного сырья принимают участие большое количество ферментов. Каждый из них проявляет свою специфичность в отношении конкретного субстрата и при определенных условиях протекания процесса ферментативного гидролиза.
Дата добавления: 2016-09-28; просмотров: 1468;
