Лекция 33. Жёсткость воды
Ключевые слова:карбонатная, некарбонатная, общая жёсткость, индикатор,
комплексы, эквивалент.
Для определения общей жёсткости природной воды применяют комплексонометрическое титрование.
Жесткость водыобусловливается наличием в ней ионов Са2+ иMg2+. Для большинства производств жесткость воды является основным показателем её качества. Жесткость количественно выражается числом миллимолей (миллиграмм – эквивалентов) ионов кальция и магния в 1 л воды (ммоль/л; мг-экв/л; мэкв/л): 1мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са2+ или 12,15 мг/л ионов Mg2+. Различают жёсткость общую, карбонатную и некарбонатную.
Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов кальция и магния, которые прикипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка – «накипи»:
Са(НСО3)2 → СаСО3↓+Н2О+СО2↑;
2Mg(HCО3)2 → (MgOH)2CО3↓ +3СО2↑ +Н2О.
Таким образом, при кипячении карбонатная жесткость устраняется.
Некарбонатная (постоянная) жесткость не разрушается кипячением. Она обусловливается присутствием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов.
Общая жёсткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обусловливается суммарным содержанием вводе растворенных солей кальция и магния и выражается количеством ммоль эквивалентов в 1 л (ммоль /л, или мэкв/л, мг-экв/л).
Определение общей жесткости воды
Анализируемую воду подщелачивают аммонийной буферной смесью до рН ≈ 10. Индикатором служит обычно хромоген черный, образующий с ионами Са2+ и Mg2+ растворимые комплексы винно-красного цвета:
Са2+ + HInd2- → CaInd- + Н+ ;
винно-красный
Mg2+ + HInd2- → MgInd- + H+ .
винно-красный
Константы нестойкости этих комплексов равны соответственно 3,9∙10-6 и 1∙10-7. Смесь титруют раствором ЭДТА, при этом свободные ионы Ca2+ и Mg2+ связываются в более прочные бесцветные комплексы:
Сa2+ + [H2Y]2- → [CaY]2- + 2H+;
Mg2+ + [H2Y]2- → [MgY]2- + 2H+.
Константы нестойкости комплексов Са2+ и Mg2+ с ЭДТА гораздо меньше (2,7∙10-11 и 2∙10-9), поэтому при дальнейшем титровании в точке эквивалентности комплексы металлов c индикатором разрушаются и образуются более прочные комплексы с ЭДТА:
CaInd- + [H2Y]2- → [CaY]2-+ HInd- + H+
винно-красный синий
MgInd- + [H2Y]2- → [MgY]2- + HInd- + H+
винно-красный синий
В эквивалентной точке винно-красная окраска раствора сменяется синей вследствие накопления свободного индикатора (HInd).
По закону эквивалентов:
∑ nэкв(Me2+) = nэкв(ЭДТА) = NЭДТА∙ VЭДТА.
Следовательно общую жесткость воды можно вычислить по формуле
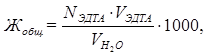
где VЭДТАи NЭДТА — соответственно объем и нормальная концентрация ЭДТА; VH2O - объем исследуемой воды.
Определение карбонатной жесткости
Временную (или карбонатную) жесткость определяют обычно по методу нейтрализации, измеряя объём соляной (или серной) кислоты, пошедшей на титрование пробы воды в присутствии индикатора метилового оранжевого:
Са(НСО3)2 + 2HCl → СаСl2 + H2CО3;
HCO3- + H+ → H2O + CO2.
В соответствии с законом эквивалентов: NHCl∙VHCl = Nсоли·VH2O.
Отсюда 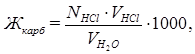
гдеNсоли, NHCl - нормальная концентрация соли и кислоты соответственно;
VHCl — объём раствора кислоты, пошедшей на титрование, мл;
VH2O — объём пробы исследуемой воды, мл.
Дата добавления: 2016-09-20; просмотров: 4055;
