Лекция 29. Йодометрическое определение окислителей методом замещения
Ключевые слова: определение окислителей заместительным титрованием.
Определять окислители прямым титрованием раствором йодида калия (KI) нельзя из-за невозможности фиксирования точки эквивалентности. Поэтому для определения окислителей применяется косвенный метод заместительного титрования (метод замещения).
Анализ проводят в две стадии. На первой стадии к аликвоте или навеске окислителя добавляется избыток 10% - го раствора йодида калия (KI) и при необходимости кислота. Йодид – ионы окисляются до йода по реакции
2Ox1 + 2zI- → zI2 + 2Red1. (1 стадия)
На второй стадии выделившийся йод оттитровывается тиосульфатом натрия в присутствии крахмального клейстера:
I2 + 2Na2S2O3 → 2NaI + Na2S4O6 . (2 стадия)
По закону эквивалентов:
nэкв(Ox) = nэкв(I2) = nэкв(Na2S2O3) = NNa2S2O3 ·VNa2S2O3,
где nэкв(Ox), nэкв(I2) и nэкв(Na2S2O3) – количество эквивалентов вещества (моль) соответственно окислителя (Ox), I2 и Na2S2O3.
Массу окислителя вычисляют по соотношению
m(Ox) = NNa2S2O3·VNa2S2O3·M(ЭOx),
где NNa2S2O3 – нормальная концентрация рабочего раствора тиосульфата натрия; VNa2S2O3 - объем раствора тиосульфата натрия, пошедший на титрование; M(ЭOx) = M(Ox)/z – молярная масса эквивалента окислителя;
z - число электронов, которое принимает одна формульная единица (атом, ион, молекула) окислителя.
По этой схеме можно определять многие окислители, способные окислить ионы I- до I2. Это Cl2, Br2, KMnO4, KClO3, CaOCl2, H2O2, Cu2+.
Важным является заместительное титрование дихромата калия, поскольку он используется в качестве стандартного вещества для определения точной концентрации рабочего раствора тиосульфата натрия. На первой стадии протекает реакция с KI в кислой среде:
K2Cr2O7 + 6KI + 7H2SO4 → 3I2 + 4K2SO4 + Cr2(SO4)3 + 7H2O. (1 стадия)
Йод, выделившийся в количестве, эквивалентном количеству дихромата, на второй стадии оттитровывается тиосульфатом натрия:
I2 + 2Na2S2O3 → 2NaI + Na2S4O6 . (2 стадия)
Количество эквивалентов вещества тиосульфата натрия nэкв(Na2S2O3), затраченного на титрование, эквивалентно количеству эквивалентов выделившегося в реакции йода - nэкв(I2), а последний - эквивалентен количеству эквивалентов вещества дихромата калия:
nэкв(K2Cr2O7) = nэкв(I2) = nэкв(Na2S2O3).
Отсюда получаем соотношение
NK2Cr2O7·VK2Cr2O7 = NNa2S2O3·VNa2S2O3,
где NK2Cr2O7 – нормальная концентрация дихромата калия; VK2Cr2O7 -объем раствора дихромата калия.
Приведенная схема анализа может быть использована для определения содержания дихромата калия или хрома. По объёму затраченного на титрование рабочего раствора тиосульфата натрия и его концентрации рассчитывается масса или нормальность раствора дихромата калия, например:
m(K2Cr2O7) = NNa2S2O3·VNa2S2O3·M(ЭK2Cr2O7),
где M(ЭK2Cr2O7) = M(K2Cr2O7)/6 = 49,03г/моль - молярная масса эквивалента дихромата калия; фактор эквивалентности равен 1/6, так как формульная единица K2Cr2O7 принимает 6 электронов.
Для расчета содержания хрома по результатам йодометрического анализа используют соотношение
m(Cr) = NNa2S2O3·VNa2S2O3·M(ЭCr),
где M(ЭCr) = M(Cr)/3 = 17,33г/моль - молярная масса эквивалента хрома; фактор эквивалентности равен 1/3, так как каждый атом хрома в K2Cr2O7 принимает 3 электрона.
Приведенная схема анализа используется также для определения катионов, образующих малорастворимые хроматы (Pb2+, Ba2+, Sr2+ и др.). Анализируемый катион осаждают в виде хромата, который после отделения определяют йодометрически. На первой стадии протекает реакция с KI, например:
2PbCrO4 + 6KI + 8H2SO4 → 3I2 + 3K2SO4 + 2PbSO4 + Cr2(SO4)3 + 8H2O.
По результатам титрования выделившегося йода раствором тиосульфата натрия рассчитывают содержание свинца по соотношению:
nэкв(Pb) = nэкв(PbCrO4) = nэкв(Cr) = nэкв(I2) = nэкв(Na2S2O3) = NNa2S2O3·VNa2S2O3;
m(Pb) = NNa2S2O3 ·VNa2S2O3 ·M(ЭPb),
где M(ЭPb) = M(Pb)/3 = 69,07г/моль - молярная масса эквивалента свинца; фактор эквивалентности равен 1/3, так как формульная единица PbCrO4 принимает 3 электрона в реакции с KI.
Йодометрическое определение содержания меди в растворе основано на реакции
Cu2+ + I- + ē → CuI; (процесс восстановления)
2I- + 2ē → I2 ; (процесс окисления)
2Cu2+ + 4I- → 2CuI↓ + I2 .
Стандартный окислительно-восстановительный потенциал пары φ0Cu2+/Cu+ = 0,17B, меньше потенциала пары φ0I2/2I- = 0,545B. Однако, поскольку в результате реакции образуется труднорастворимый йодид меди(I), концентрация ионов меди(I) уменьшается. В результате окислительно - восстановительный потенциал пары - Cu2+/CuI -увеличивается и оказывается, больше потенциала пары – I2/I-: φCu2+/CuI = 0,865 В > φ0I2/2I- = 0,545 В. Поэтому окислительно – восстановительная реакция между ионами меди(II) и йодидом возможна и протекает количественно. Взаимодействие проводят в кислой среде для подавления гидролиза ионов меди(II).
Как и другие окислители в йодометрии, медь определяют методом замещения, титруя выделившийся йод, эквивалентный содержанию меди, тиосульфатом натрия. Содержание меди рассчитывают по закону эквивалентов:
nэкв(Cu) = nэкв(I2) = nэкв(Na2S2O3) = NNa2S2O3 ·VNa2S2O3;
m(Cu) = NNa2S2O3 ·VNa2S2O3 ·M(ЭCu),
где M(ЭCu) = M(Cu) = 63,54 г/моль - молярная масса эквивалента меди; фактор эквивалентности равен 1, так как ион меди(II) принимает 1 электрон в реакции с йодидом калия.
Определение пероксидов. Неорганические и органические пероксиды восстанавливаются йодидом калия в кислой среде, например:
H2O2 + 2I- + 2H+ → I2 + 2H2O.
Выделившийся эквивалентно пероксиду йод оттитровывают раствором тиосульфата натрия. Содержание пероксида рассчитывают по соотношению
m(H2O2) = NNa2S2O3 ·VNa2S2O3 ·M(ЭH2O2),
где M(ЭH2O2) = M(H2O2)/2 = 17 г/моль - молярная масса эквивалента перекиси водорода; фактор эквивалентности равен 1/2, так как молекула H2O2 принимает 2 электрона в реакции с йодидом калия.
Метод йодометрии применяют для определения содержания соединений железа(III). Ионы Fe3+ окисляют йодид ион в кислом растворе по реакции
2Fe3+ + 2I- → 2Fe2+ + I2.
Окисление протекает количественно. Раствор должен быть довольно кислым для подавления гидролиза соединений железа (III). Однако в сильно-кислой среде возрастает «кислородная ошибка» в результате окисления йодида кислородом воздуха. Выделившийся йод титруют раствором тиосульфата натрия. Содержание железа рассчитывают по соотношению
m(Fe) = NNa2S2O3·VNa2S2O3·M(ЭFe),
где M(ЭFe) = M(Fe) = 55,85 г/моль - молярная масса эквивалента железа; фактор эквивалентности равен 1, так как ион железа(III) принимает 1 электрон в реакции с йодидом калия.
Контрольные вопросы
1. Схема йодометрического определения окислителей.
2. Какой индикатор используется при йодометрическом определении окислителей и можно ли его добавлять в начале титрования?
3. Определение методом йодометрии и расчет содержания хрома.
4. Определение методом йодометрии и расчет содержания меди.
5. Определение методом йодометрии и расчет содержания пероксидов.
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 240 – 243.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С. 175 - 178.
О.Б. Чалова
Лекция 30. Количественный химический анализ нефтепродуктов
Ключевые слова: кислотное число, йодное число, бромное число нефтепродукта; кислотное число, эфирное число, число омыления синтетических жирных кислот.
Для анализа нефти и нефтепродуктов наряду с физическими, физико-химическими и специальными методами широко используются химические методы анализа. При выполнении анализов строго учитывают правила и инструкции, требования к отбору проб, выбор метода и расчеты результатов анализа в соответствии с ГОСТами или техническими условиями.
Важным показателем качества нефтепродукта является его кислотность. Кислотность нефти (кислотное число) определяют по содержанию в ней нафтеновых, карбоновых и оксикарбоновых кислот, фенолов и других соединений кислотного характера. Общая кислотность нефти или нефтепродукта обычно выражается массой (мг) КОН, идущего на нейтрализацию всех кислых органических соединений, отнесенного к единице объема или массы анализируемого образца. Кислотность бензинов, лигроинов и дизельных топлив выражается в мг КОН на 100 см3 анализируемого нефтепродукта. Для авиабензинов и топлива кислотное число не должно превышать 1, для автомобильных бензинов — 3, керосинов — 5.
Нефтепродукты и органические соединения не растворяются в воде, поэтому их определение проводят в среде органического растворителя. Органические кислоты экстрагируют из отмеренного объема (V) анализируемого нефтепродукта кипящим этанолом, затем титруют спиртовым раствором гидроксида калия. Реакция протекает в соответствии с общим уравнением
RCOOH + KOH → RCOOK + H2О.
По результатам титрования кислотное число (КЧ, г/100 мл) рассчитывают по формуле
КЧ = VKOH·TKOH·100/V,
где VKOH — объем раствора КОН, пошедший на титрование пробы, мл; ТKOH — титр раствора КОН, г/мл; V — объем пробы нефтепродукта, мл.
Химический состав нефтепродуктов определяет их эксплуатационные свойства. Нефтепродукты, содержащие непредельные углеводороды, химически недостаточно стабильны. Все методы количественного определения содержания непредельных углеводородов в нефтепродуктах основаны на реакциях присоединения реагентов. Наиболее распространены методы, в которых о количестве непредельных углеводородов судят по бромным и йодным числам.
Йодное число (ИЧ, г/100г) характеризует содержание непредельных соединений в нефтепродукте и равно массе (г) йода, которая присоединяется к 100 г нефтепродукта.
Йодные числа для авиабензинов и дизельных топлив нормируются, их допустимые значения от 0,1 г в бензине – растворителе до 10-20 г в дизельном топливе. Для определения йодного числа применяют метод обратного йодометрического титрования. На первой стадии проводят реакцию между спиртовым раствором йода и спиртовым раствором нефтепродукта в присутствии большого избытка воды. Происходит диспропорционирование йода по реакции
I2 + Н2O → HIO + HI.
Затем образовавшаяся иодноватистая кислота (HIO) реагирует с ненасыщенными углеводородами, присоединяясь по двойным связям:
RCH=CHR'+2HIO + C2H5OH → RCHI-CHIR'+CH3COOH+2Н2O.
На второй стадии анализа избыток йода титруют раствором тиосульфата натрия:
I2 + 2 S2O32- → 2I- + S4O62-.
Йодное число (ИЧ) рассчитывают по формуле
ИЧ=(V – V1)·Т·100/m,
где V - объем раствора Na2S2O3, пошедший на титрование йода в контрольном опыте, мл; V1 -объем раствора Na2S2O3, пошедший на титрование при анализе нефтепродукта, мл; T - титр раствора Na2S2O3, г/мл; m - навеска образца нефтепродукта, г.
Содержание (ω, масс. доли, %) непредельных углеводородов в образце рассчитывают по йодному числу:
ω = (ИЧ·М) /254,
где 254 г/моль – молярная масса йода; М – молярная масса нефтепродукта, которую определяют криоскопическим методом. Для авиационных бензинов молярная масса может быть принята равной 100, для реактивных топлив – 175.
Определение бромного числа бромид-броматным методомосновано на взаимодействии непредельных углеводородов с бромом в момент его выделения. Бром образуется в растворе в ходе реакции, между KBr и KBrОз в кислой среде: BrO3- + 5Br- + 6Н+ → 3Н2O+3Br2.
Бром присоединяется по двойным связям:
RCH2-CH=CH2 + Br2 → RCH2-CHBr-CH2Br.
Избыток свободного брома вступает в реакцию с добавленным KI:
Br2 + 2KI → I2 + 2KBr.
Выделившийся йод титруют тиосульфатом натрия.
Бромное число (БЧ) равно массе (г) брома, которая присоединяется к 100 г нефтепродукта, его рассчитывают по формуле
БЧ = (V – V1)·TNa2S2O3/Br2·100/m,
где V и V1 — объем тиосульфата натрия, пошедший на титрование йода в контрольном опыте и в анализе пробы нефтепродукта соответственно, см3;
ТNa2S2О3/Br2— титр рабочего раствора тиосульфата по брому, то есть масса брома (г), соответствующая 1 мл раствора Na2S2О3; m — навеска образца нефтепродукта, г.
Из нефти и нефтепродуктов получают разнообразные химические соединения и технические материалы. Например, синтетические жирные кислоты получают в процессе окисления твердого парафина или жидкого парафинового сырья. В результате образуется сложная смесь кислородсодержащих соединений кислотного или нейтрального характера: жирные кислоты, оксикислоты, дикарбоновые и кетонокислоты, спирты, эфиры, лактоны и другие продукты. Контроль качества синтетических жирных кислот осуществляют химическими методами по следующим параметрам. Определяют кислотное и эфирное числа, число омыления, содержание карбоновых кислот и др. Содержание сложных эфиров (эфирное число) и свободных кислот (кислотное число) определяют экспериментально и выражают в мг КОН, затрачиваемого на нейтрализацию 1 г исследуемого продукта. Кислотное число (КЧ1) определяют титрованием образца раствором КОН в этаноле в присутствии фенолфталеина и рассчитывают по формуле КЧ1 = (VKOH·TKOH ·1000)/ m, [мг/г],
где VKOH — объем раствора КОН, пошедший на титрование навески в присутствии фенолфталеина, мл; ТKOH — титр раствора КОН, г/мл; m — навеска жирных кислот, г.
Для определения эфирного числа (ЭЧ) проводят гидролиз (омыление) образца избытком раствора КОН в этаноле по реакции
R-COOR' + KOH → R-COOK + HOR'.
Далее избыток щелочи оттитровывают раствором НС1 в присутствии фенолфталеина до его обесцвечивания.
Эфирное число (ЭЧ) рассчитывают по формуле
ЭЧ = (V1 – V2) ·TНС1/КОН ·1000/ m, [мг/г],
где V1 — объем раствора HC1, пошедший на титрование КОН в контрольном опыте, мл; V2 — объем раствора HC1, пошедший на титрование КОН в анализе навески кислот, мл; TНС1/ КОН - титр раствора HC1по КОН, то есть масса КОН, эквивалентная 1 мл раствора НС1, г/ мл; m — навеска синтетических жирных кислот, г.
Число омыления (ОЧ) рассчитывают как сумму кислотного и эфирного чисел: ОЧ = КЧ1 + ЭЧ.
Контрольные вопросы
1.Определение и расчет кислотного числа нефтепродуктов.
2.Определение и расчет йодного числа нефтепродуктов.
3.Определение и расчет кислотного числа, эфирного числа и числа омыления синтетических жирных кислот.
Список рекомендуемой литературы
1. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С. 291 - 293.
2. Посыпайко В.И., Козырева Н.А., Логачева Ю.П. Химические методы анализа: учеб. пособие для хим. – технол. вузов. - М.: Высшая школа, 1989. – С. 342 - 358.
Л.Н. Зорина
Лекция 31. Комплексонометрическое титрование. Область применения, рабочие растворы, металл-индикаторы.
Ключевые слова: комплексные соединения, комплексон, комплексообразователь,
металл-индикаторы.
В титриметрии широко применяют реакции, приводящие к образованию комплексных соединений катионов с органическими реактивами, называемыми комплексонами. Эти реакции сопровождаются образованием внутрикомплексных (клешневидных, хелатных) солей.
Комплексонами обычно называют органические соединения – производные аминополикарбоновых кислот. Простейший комплексон – нитрилотриуксусная кислота - комплексон I (сокращённо H3Y):
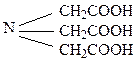
Наибольшее значение имеет четырёхосновная этилендиаминтетрауксусная кислота – комплексон II (сокращённо H4Y или ЭДТУ):
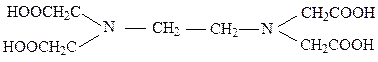
На практике обычно применяют динатриевую соль этилендиаминтетрауксусной кислоты, называемую комплексоном III (сокращённо Na2H2Y или ЭДТА). При титровании комплексоном III солей металлов – комплексообразователей протекают следующие реакции:
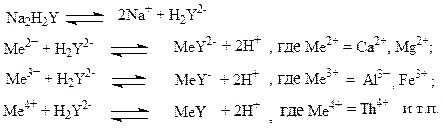
Согласно приведённым уравнениям, 1моль катионов, реагирующих с комплексоном III, связывает 1 моль комплексона независимо от степени окисления металла, реакция протекает стехиометрично.
Комплексоны наряду с карбоксильными группами (-СOOH) содержат атом азота с неподелённой парой электронов, благодаря чему эти соединения обладают полидентатностью, то есть способностью образовывать сразу несколько координационных связей с ионами металлов – комплексообразователей:
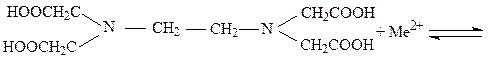
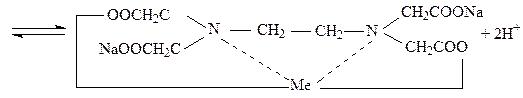
В ходе титрования в анализируемом растворе изменяется концентрация свободных катионов металла. Поэтому кривые титрования в комплексонометрии строят, откладывая на оси ординат значение
рМе = —lg[Me], (где [Ме] — молярная концентрация титруемого катиона металла), а на оси абсцисс — количество израсходованного на титрование раствора комплексона.
В качестве индикаторов в комплексонометрии применяют металл-индикаторы, позволяющие визуально определить точку конца титрования. Металл-индикаторы – органические соединения, образующие окрашенные комплексные соединения с ионами металла, менее прочные, чем комплекс металла с комплексоном. Чаще всего применяют хромоген чёрный (эриохром чёрный Т) и мурексид. Хромоген чёрный – трёхосновная кислота (H3Ind), диссоциирует в зависимости от рН по схеме
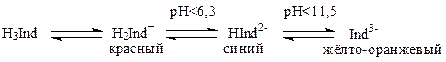
При рН = 7—11, когда индикатор имеет синий цвет, многие ионы металлов образуют с ним комплексы красного цвета, например такие ионы, как Mg2+, Ca2+, Zn2+, Cd2+, Al3+, Co2+, Ni2+, Cu2+ и др.
Реакции Са2+ и Mg2+ с индикатором можно представить уравнением
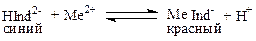
Следовательно, если в раствор, например соли кальция, при рН = 7—11 ввести хромоген черный, то раствор окрасится в красный цвет, если этот раствор титровать раствором комплексона III, который с Са2+ дает бесцветный, более прочный комплекс, чем комплекс Са2+ с индикатором, то в конечной точке титрования раствор примет синий цвет.
Контрольные вопросы
1.Основные комплексоны, использующиеся в титриметрии.
2.Металл-индикаторы, требования, предъявляемые к ним.
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 189 – 200.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С. 212 - 226.
Л.Н. Зорина
Дата добавления: 2016-09-20; просмотров: 13372;
