Лекция 36. Произведение растворимости. Расчёт растворимости
Ключевые слова: насыщенный раствор, произведение растворимости, растворимость
малорастворимых электролитов.
При проведении гравиметрического анализа для выбора осадителя очень важно рассчитать растворимость осадка и его возможные потери за счёт растворимости. Раствор, содержащий максимальное количество вещества, которое может раствориться в данном количестве растворителя при данной температуре, называют насыщенным.
Если электролит растворяется в воде мало, то быстро наступает равновесие: вещество в осадке – ионы вещества в насыщенном растворе. Например:
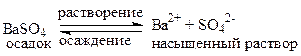
Константа равновесия такого гетерогенного процесса называется произведением растворимости (ПР) и для нашего примера в отсутствии других сильных электролитов записывается следующим образом:
ПРBaSO4 = [Ba2+]·[SO42-],
где [Ba2+] и [SO42-] - равновесные молярные концентрации соответствующих ионов в насыщенном растворе.
В насыщенном растворе малорастворимого сильного электролита произведение молярных концентраций ионов в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при постоянной температуре.
Численные значения констант (ПР) для стандартной температуры определяются экспериментально и приводятся в таблицах. Выражение для константы ПР определяется составом электролита и его электролитической диссоциацией на ионы. В общем случае для плохо растворимого сильного электролита, диссоциация которого осуществляется по уравнению:
AnBm  nAm+ + mBn-.
nAm+ + mBn-.
Выражение для константы ПР записывается по следующей форме:
ПР AnBm = [Am+]n ·[Bn-]m,
где [Am+] и [Bn-] – равновесные молярные концентрации соответствующих катионов и анионов в насыщенном растворе; n, m – коэффициенты, показывающие число соответствующих ионов, образующихся при электролитической диссоциации формульной единицы электролита.
Например, для ортофосфата кальция:
Ca3(PO4)2  3 Ca2+ + 2 PO43- (уравнение диссоциации)
3 Ca2+ + 2 PO43- (уравнение диссоциации)
ПРCa3(PO4)2 = [Ca2+]3 · [PO43-]2.
По величине константы произведение растворимости (ПР) можно рассчитать концентрации ионов в насыщенных растворах, изменение концентрации одних ионов в зависимости от изменения концентрации других ионов, делать предварительные выводы о выпадении, не выпадении или растворении осадков, о влиянии одноимённых ионов.
Обычно величины ПР могут быть вычислены по данным растворимостей (S), найденным экспериментальным путём. И, наоборот, по величине ПР рассчитывают растворимость плохо растворимых сильных электролитов. Растворимость - это концентрация насыщенного раствора при данной температуре. Она может быть выражена молярной концентрацией растворенного вещества (моль/л) в насыщенном растворе либо массой (г) растворенного вещества в 1 л насыщенного раствора, либо массой растворенного вещества (г), необходимой для насыщения 100 г растворителя.
Рассмотрим расчёт растворимости по величине ПP на следующих примерах.
Пример 1. Определить растворимость в воде сульфата бария (BaSO4) в моль/л и в г/л.
Решение.
BaSO4  Ba2+ + SO42- (уравнение диссоциации)
Ba2+ + SO42- (уравнение диссоциации)
S моль/л S моль/л S моль/л
ПРBaSO4 = [Ba2+] · [SO42-] = 1,1· 10-10 .
Если в 1 л растворилось S моль/л BaSO4, то концентрации ионов в соответствии с уравнением диссоциации равны:
[Ba2+] = [SO42-] = S (моль/л). Подставим это значение в выражение для ПРBaSO4 и получим уравнение с одним неизвестным: ПРBaSO4 = S2 .
Следовательно, S = [ПРBaSO4 ]1/2 = [1,1 ·10-10 ]1/2 = 1,05 ·10-5 моль/л.
Расчет массы BaSO4 в 1 л насыщенного раствора (растворимости в г/л) осуществляем по соотношению
СBaSO4= S·M(BaSO4) = 1,05·10-5 ·233= 2,45·10-3 г/л.
Поскольку по результатам расчета растворимость сульфата бария в воде: S = 1,05·10-5 > 10-6 моль/л, его осаждение не является количественным, полным при использовании эквивалентного количества осадителя – серной кислоты. Считается, что ион практически полностью осаждён, если потерю его массы невозможно взвесить на аналитических весах.
Пример 2. Вычислить растворимость (моль/л) в воде Ca3(PO4)2, если ПРCa3(PO4)2= 3 10-33.
Решение.
Ca3(PO4)2  3 Ca2+ + 2 PO43- (уравнение диссоциации)
3 Ca2+ + 2 PO43- (уравнение диссоциации)
S моль/л 3S моль/л 2S моль/л
В соответствии с уравнением диссоциации, если S моль/л Ca3(PO4)2 растворилось в 1 л, концентрации ионов равны: [Ca2+] = 3S и [PO43-] = 2S.
Подставляем эти значения в выражение для ПРCa3(PO4)2, и решаем уравнение с одним неизвестным:
ПРCa3(PO4)2 = [Ca2+]3 · [PO43-]2 = 3 ·10-33. ; (3S)3· (2S)2 = 3·10-33.
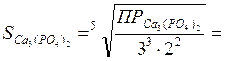
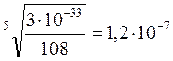 моль/л.
моль/л.
Пример 3. Рассчитать растворимость (моль/л) сульфата бария (BaSO4) в 0,01 М растворе Na2SO4 (без учета ионной силы раствора).
Решение.
Na2SO4 → 2 Na+ + SO42- (уравнение диссоциации)
0,01моль/л 0,01 моль/л
BaSO4  Ba2+ + SO42- (уравнение диссоциации)
Ba2+ + SO42- (уравнение диссоциации)
S моль/л S моль/л S моль/л
ПРBaSO4 = [Ba2+]·[SO42-] = 1,1·10-10
Если в 1 л растворилось S моль/л BaSO4, то концентрации ионов в соответствии с уравнениями диссоциации равны:
[Ba2+] = S ; [SO42-] = 0,01 + S ≈ 0,01
Подставим эти значения в выражение для ПРBaSO4 и получим уравнение с одним неизвестным: ПРBaSO4 = S·0,01 .
Следовательно, S = ПРBaSO4/[SO42-] = 1,1·10-10 /0,01 = 1,1·10-8 моль/л.
Сравним растворимость BaSO4 в воде и в 0,01 М растворе Na2SO4.
S(в воде) / S(в 0,01 М Na2SO4) = (1,05·10-5)/ (1,1·10-8 ) = 955.
То есть в 0.01 М растворе сульфата натрия растворимость сульфата бария в 955 раз меньше, чем в воде. При определении иона бария, осаждение и промывание сульфата бария проводят в присутствии избытка одноимённого сульфат – иона, то есть избытком раствора серной кислоты.
Из приведённого примера следует, что растворимость осадка малорастворимого сильного электролита в воде больше, чем в растворе электролита, имеющем общий ион с осадком. Поэтому для полного количественного осаждения определяемого иона необходимо использовать примерно полуторакратный избыток осадителя, так как он содержит одноимённый с осадком ион. Избыток различных осадителей по разному влияет на растворимость осадка. В некоторых случаях осадок растворяется в избытке осадителя, например, в результате комплексообразования или солевого эффекта.
Контрольные вопросы
1.Что такое произведение растворимости, и что оно характеризует?
2.Какие расчёты можно сделать по величине произведения растворимости?
3.Как рассчитать растворимость плохо растворимого сильного электролита в воде?
4.Как влияет избыток одноимённого иона на растворимость вещества?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 252 – 257.
2. Хаханина Т.И., Никитина Н.Г. Аналитическая химия: учеб. пособие. – 2 – е изд., перераб. и доп. - М.: Изд-во «Юрайт»; Высшее образование, 2010. – С. 27 – 30.
Л.Е. Салова
Дата добавления: 2016-09-20; просмотров: 33259;
