Чому ці структури назвали бакмінстерфулеренами (фулеренами)? 6 страница
54. Wang X., Ozkan G. (2008) Multisegment Nanowire Sensors for the Detection of DNA Molecules. Nano lett, 8(2): 398 – 404
55. Weizmann Y., Braunschweig A. B., Wilner O. I. Et al. (2008) A polycatenated DNA scaffold for the one-step assembly of hierarchical nanostructures. PNAS, 105(14): 5289–5294.
56. Willner I., Basnar B., Willner B. (2007) Nanoparticle–enzyme hybrid systems for nanobiotechnology. FEBS Journal, 274: 302 – 309.
57. Wu T., Sun T., Li N. et al. (2007) Inhibiting Surface Crystallization of Amorphous Indomethacin by Nanocoating. Langmuir, 23(9): 5148-5153.
58. Zhang L., Swift J., Butts A. (2007) Structure and activity of apoferritin-stabilized gold nanoparticles. J. Inorg. Biochem, 101: 1719 – 1729.
Мідь.
Мідь (Cuprum, Сu) – хімічний елемент I групи періодичної системи елементів Д.І. Мендєлєєва.
Історія відкриття міді. Латинська назва cuprum виникла від назви острова Кіпр, де древні греки добували мідну руду. В давнину для обробки скальної породи її нагрівали на вогні і швидко охолоджували, при цьому порода розтріскувалася. При цих умовах були можливі процеси відновлення. В подальшому відновлення проводили на вогні з великою кількістю вугілля і з вдуванням повітря за допомогою труб. Вогнище оточували стінами, які поступово підвищувались, що призвело до створення шахтної печі. Пізніше методи відновлення поступилися місцем окислювальній плавці сульфідних мідних руд з отриманням проміжних продуктів – штейни (сплаву сульфідів), в якому концентрується мідь і шлаку (сплаву окислів). Ще 3000 до н.е. в Індії, Месопотамії і Греції для виплавки більш твердої бронзи в мідь стали додавати олово. Відкриття бронзи могло бути випадковим, проте її переваги у порівнянні з чистою міддю швидко вивели цей сплав на перше місце. Так почався “бронзовий вік” [Осинцев14].
Фізичні, хімічні, фізикохімічні властивості міді детально досліджені [Осинцев; Подмагайло; ПодчайноваФролов]. Мідь – розувато-червоний метал, при просвітлюванні в тонких шарах зеленувато – блакитний, м’який та ковкий, добрий провідник тепла і електрики, поступається цим якостям лише сріблу, входить в сімку найбільш цінних металів на ряду із золотом, сріблом, залізом, свинцем, оловом і ртуттю. Мідь відноситься до групи самородних металів. Найважливішими сплавами міді є: бронза, латунь, мельхіор.
Сплави міді володіють невеликою хімічною активністю, тому знаходяться частково у вигляді хімічних з’єднань, а частково у вільному вигляді. Мідь в далекі геологічні епохи, очевидно, знаходилася лише у вигляді сульфідних з’єднань – халькопіриту і халькозину, внаслідок хімічної спорідненості з сіркою.
Самородна (металічна) мідь виникла в природі при сильному нагріванні частково окислених сульфідних руд. Після землетрусів окислені мінерали міді знаходилися під товстим шаром гірських порід і нагрівалися за рахунок земного тепла. При цьому відбувалася взаємодія окислів з сульфідами. Деякі інші мінерали міді отримали із окисних руд. Наприклад, під дією вологи і двооксиду вуглецю проходить гідратація оксиду міді і утворення основних карбонатів.
Фізичні властивості міді. Метали підгрупи міді, як і лужні метали, мають по одному вільному електрону на один іон-атом металу. Але на відміну від лужних металів, такі сполуки володіють достатньо високими температурами плавлення. Метали підгрупи міді, у порівнянні з лужними металами, володіють більшою твердістю. Твердість та міцність металів залежить від правильності розміщення іон-атомів в кристалічній решітці. Червоний колір міді обумовлений наявністю в ній розчиненого кисню. При відсутності кисню мідь має жовтуватий колір. При підвищенні валентності знижується забарвленість міді, наприклад CuCl – білий, Сu 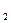 O – червоний, CuCl + H
O – червоний, CuCl + H 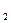 O – блакитний, CuO – чорний. Карбонати характеризуються синім і зеленим кольором при наявності води.
O – блакитний, CuO – чорний. Карбонати характеризуються синім і зеленим кольором при наявності води.
Хімічні властивості міді. Мідь проявляє до кисню незначну активність, але у вологому повітрі поступово окислюється і покривається плівкою зеленуватого кольору. В сухому повітрі окислення відбувається повільно, на поверхні міді утворюється дуже тонкий шар оксиду міді. Також мідь окислюється при нагріванні (при 600-800 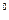 С). В перші секунди окислення здійснюється до оксиду міді (І), яка з поверхності переходить в оксид міді (ІІ) чорного кольору. Утворюється двошарове окисне покриття.
С). В перші секунди окислення здійснюється до оксиду міді (І), яка з поверхності переходить в оксид міді (ІІ) чорного кольору. Утворюється двошарове окисне покриття.
Мідь може взаємодіяти з водою. Метали підгрупи міді знаходяться в кінці електрохімічного ряду напружень, після іону водню. Тому ці метали не можуть витісняти водень із води. В той час водень та інші метали можуть витісняти метали підгрупи міді із розчинів їх солей. Мідь при відсутності кисню з водою практично не взаємодіють. В присутності кисню мідь повільно взаємодіє з водою і покривається зеленою плівкою гідроксиду міді і основного карбонату.
Взаємодія з кислотами. Знаходячись в ряді напруг після водню, мідь не витісняє його з кислот. Тому соляна і розведена сірчана кислота на мідь не діють. Проте в присутності кисню мідь розчиняється в цих кислотах з утворенням відповідних солей. Мідь добре реагує з галогенами. При дії галогенів при кімнатній температурі видимих змін не відбувається, але на поверхні спочатку утворюється шар адсорбованих молекул, а потім і тонкий шар галогенідів. Одновалентні галогеніди міді отримують при взаємодії металічної міді з розчином галогеніду міді (ІІ). При прожарюванні міді в повітрі, вона покривається чорним нальотом, що складається з оксиду міді. Його також можна отримати прожарюванням гідроксикарбонату міді (ІІ) (СuOH) 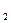 CO
CO 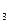 чи нітрату міді (ІІ) Cu(NO
чи нітрату міді (ІІ) Cu(NO 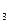 )
) 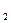 . При нагріванні з різними органічними речовинами СuO окислює їх, перетворюючи вуглець в діоксид вуглецю, а водень – у воду відновлюючись при цьому в металічну мідь.
. При нагріванні з різними органічними речовинами СuO окислює їх, перетворюючи вуглець в діоксид вуглецю, а водень – у воду відновлюючись при цьому в металічну мідь.
Гідроксид міді малорозчинне і нестійке з’єднання. Отримують його при дії лугу на розчин солі. Це іонна реакція і протікає вона тому, що утворюється погано дисоційоване з’єднання, яке випадає в осад. Мідь, крім гідроксиду міді, (ІІ) блакитного кольору, утворює ще гідроксид міді (І) білого кольору. Це нестійке з’єднання, яке легко окислюється до гідроксиду міді (ІІ). Гідроксиди міді володіють амфотерними властивостями. Наприклад, гідроксид міді (ІІ) добре розчинний не лише в кислотах, але й в концентрованих розчинах лугів. Таким чином, гідроксид міді (ІІ) може дисоціювати як основа, так і кислота. Цей тип дисоціації пов'язаний з приєднанням міді гідроксильних груп води.
Найбільш практичне значення має CuSO 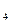 *5H
*5H  O, що отримав назву мідний купорос. Його готують розчиненням міді в концентрованій сірчаній кислоті. Оскільки мідь відноситься до малоактивних металів і розміщена в ряді напруг після водню, водень при цьому не виділяється.
O, що отримав назву мідний купорос. Його готують розчиненням міді в концентрованій сірчаній кислоті. Оскільки мідь відноситься до малоактивних металів і розміщена в ряді напруг після водню, водень при цьому не виділяється.
Застосування препаратів міді в медицині.Мідь – важливий елемент життя, що приймає участь в багатьох фізіологічних процесах: синтезі гемоглобіну, утворенні кісткової тканини, функціонуванні системи кровотворення і центральної нервової системи. Щоденна потреба дорослої людини в міді складає 2 – 3 мг. Мідь входить до складу таких ферментів: тирозиназа, цитохромоксидаза. Виводиться мідь з організму переважно через шлунково-кишковий тракт, в меншій мірі – через нирки. При прийомі препаратів міді per os біoметал швидко всмоктується і реєструється в крові вже через 30-40 хв. Солі металічної міді, як і срібла, володіють антибактеріальними і протигрибковими властивостями [Бабенко5].
Препарати з вмістом міді застосовують при переломах кісток з метою прискореної регенерації, для лікування ревматоїдного артриту, пептичної виразки шлунку та дванадцятипалої кишки, при інфарктах міокарда. Мідь застосовують для прискорення процесу загоєння ран, завдяки бактеріостатичній дії. Мідь регулює в організмі рівень холестерину в крові, цукру і сечової кислоти, підтримує баланс мікрофлори кишечнику, гальмуючи ріст дріжджових мікроорганізмів [Бабенко].
Мідь приймає участь у формуванні структури білків сполучної тканини – колагену та еластину, які є структурними компонентами кісткової та хрящової тканини, шкіри, легень, стінок кровоносних судин. Мідь впливає на функцію печінки, селезінки і лімфатичної системи, регулює жировий обмін.
Мідь підвищує стійкість організму до гіпоксії, сприяє регенерації тканин (наприклад, запобігає виникненню виразки шлунку, яка виникає на фоні приймання великих доз аспірину), підсилює дію антибіотиків. Приймає участь в синтезі мієліну – оболонки нервових волокон. Даний біометал стимулює імунітет, впливає на первинні та вторинні імунні реакції, виявляє гіпоглікемічний ефект, підсилюючи дію інсуліну. Зменшує розпад глікогену в печінці; впливає на синтез тирозину – фактор пігментації волосся і шкіри, а також покращує засвоєння вітаміну Р і є його синергістом [Imes22].
Дефіцит міді в організмі проявляється порушенням мінералізації кісток, розвитком остеопорозу, частими переломами кісток. При дефіциті міді підвищується ризик виникнення ішемічної хвороби серця, порушується ліпідний обмін з розвитком атеросклерозу, утворення аневризм стінок кровоносних судин, пригнічується синтез тироксину, пігментація волосся і шкіри, прискорюється дегенерація мієлінових оболонок нервових клітин, підвищення ризику розвитку розсіяного склерозу, цукрового діабету, гіпотиреозу. Відмічається пригнічення функції імунної системи, порушення гемоглобіноутворення, пригнічення кровотворення [Коломийцева].
Синтез наночастинок міді.Після введення водного розчину міді, міцелярний розчин кверцетину забарвлюється в яскраво-жовтий колір, потім розчин швидко темніє, набуває жовто-коричневе забарвлення. Проте комплекс швидко розпадається з утворенням атомів міді і окисленого кверцетину. Швидкість утворення та розпаду комплексу залежить від параметрів системи (концентрацій міді та кверцетину, ступеню гідратації середовища). Для синтезу наночастинок міді використовували сульфат міді, деіонізовану воду, а для отримання зворотніх міцел – поверхнево-активні речовини (натрієву сіль біс -(2-етилгексил) сульфосукцинату), в якості же розчинника – октан, ізооктан, в якості відновника – кверцетин. Наночастинки міді із міцелярних розчинів наносили на неорганічні носії: оксид алюмінію чи крупнопористий силікагель. Для проведення каталітичних процесів застосовували 3,4-дихлорбутен-1 і хроматографічний чистий чотирьох хлористий вуглець [Ершов10].
Із міцелярного розчину наночастинки міді осаджували на тверді неорганічні оксиди алюмінію і кремнію. Адсорбцію наночастинок реєстрували по змінам спектрів оптичного поглинання міцелярного розчину після занурення адсорбенту [Kitagawa25].
Розроблений новий спосіб отримання стабільних металічних наночастин – метод біохімічного синтезу в зворотних міцелах. Даний метод відноситься до групи хімічних, в яких наночастинки отримують шляхом хімічного відновлення іонів металів із їх солей. Використання системи зворотних міцел при хімічному синтезі збільшило час життя наночастинки в присутності кисню повітря до року і більше [Трахтенберг19].
Введення органічних лігандів на покриття наночастинок збільшує можливість їх використання за рахунок попередження утворення агломератів (злипання один з одним). Проводилися дослідження, в яких встановлені біоцидні та консервуючі властивості нанодисперсій міді та препаратів на їх основі. В якості активної основи–субстрату використовували суперконцентрати нанодисперсій металічних частинок міді, які були отримані методом рідиннофазного відновлення. Згідно з даних досліджень дисперсії і препарати на їх основі володіють високою бактерицидною активністю до різних видів мікроорганізмів [Егорова9].
Каталітичні властивості наночастинок міді. Мідь є сильним дегалогенуючим агентом. Процеси дегалогенування і конденсації галогеналкілів виявлено як на кристалічній міді, так і парів міді. Припускається, що пари міді здійснюються через проміжок утворення алкільних радикалів. Також відома властивість наночастинок каталізувати реакції з участю вільних радикалів. Тому саме реакції галогенвуглеводнів обрані в якості модельних процесів для вивчення каталітичних властивостей стабільних наночастинок міді в міцелярних середовищах [Егорова 9].
Наночасинки міді виявляють кардіопротекторну дію – підвищують виживаємість при інфаркті міокарда. Мають бактерицидні властивості, в тому числі по відношенню до деяких антибіотикорезистентних бактерій [Hirsch L.R. et al.].
Застосування наночастинок міді в медицині.Наночастинки міді виявляють кардіопротекторну дію – підвищують виживання при інфаркті міокарда. Бактерицидні властивості наночастинок даного біометалу мають широкий спектр протимікробної дії, активні проти штамів стійких до антибіотиків. Наночастинки міді менш токсичні солей цього біoметалу [Ершов10].
Заключення.Наночастинки міді виявляють кардіопротекторну дію – підвищують виживання при інфаркті міокарда. Бактерицидні властивості наночастинок даного біометалу мають широкий спектр антимікробної дії, активні проти штамів стійких до антибіотиків. Наночастинки міді менш токсичні солей цього біометалу. Подальші розробки та створення лікарських засобів на основі наночастинок міді та оксиду міді потребують методів стандартизації наночастинок, з метою збереження біологічної активності.
Мідь (ост. вар.)
1.Бабенко Г.А. Биологическая роль меди. – М.: Наука, 1970. – 239 с.
2. Егорова Е.М., Ревина А.А., Ростовщикова Т.Н., Киселева О.И. Бактерицидные и каталитические свойства стабильных металлических наночастиц в обратных мицеллах. – Вестн. Моск. ун-та. Сер. 2. – Изд. Химия. – 2001. – Т. 42, №5. – С. 332-338.
3.Ершов Б.Г. Наночастицы металлов в водных растворах: электронные, оптические и каталитические свойства // Рос. хим. жур. – 2001. Т. ХLV, №3. – С. 20-30.
4.Коломийцева М.Г., Габович Р.Д. Микроэлементы в медицине. – М.: Медицина, 1970. – . 287 с.
5. Осинцев О.Е., Федоров В.Н. Медь и медные сплавы. Отечественные и зарубежные марки. – М.: Изд. Машиностроение, 2004. – 336 с.
6. Подчайнова И.Г., Симонова Э.Н. Аналитическая химия меди. М.: Наука, 1990. – 279 с.
7. Помагайло А.Д., Розенберг А.С., Уфлянд И.Е. Наночастицы металлов в полимерах. М.: Химия, 2000. – 672 с.
8. Трахтенберг Л.И., Герасимов Г.Н., Потапов В.К., и др. Нанокомпозиционные металлполимерные пленки: сенсорные, каталитические и электрофизические свойства. – Вестн. Моск. ун-та. Сер. 2. Химия, 2001. – Т. 42. №5. – С. 105-110.
9. Фролов Ю.Г. Курс коллоидной химии. (Поверхностные явления и дисперсные системы): учебник для вузов. – М.: Химия, 1982. – 400 с.
10. Bu X.H., Tong M. L., Xie Y. B. et al. Synthesis, structures, and magnetic properties of the copper (II), cobalt (II) and manganese (II) complexes with 9-acridinecarboxylate and 4-quinolinecarboxylate ligands // Inorg. Chem. – 2005. – Vol. 44, № 26. – P. 9837-9846.
11. Hirsch L.R., Gobin A.M., Lowery A.R. et al. . Metal nanoshells // Ann. Biomed. Eng. – 2006. – Vol.34. – P. 15-22.
12. Imes S. Pinchedeck B.R., Dinwoodie A. et al. Iron, folate, vitamin B-12 zin, and copper status in out – patients with crohn’s disease: effect of diet counseling. J. Am. Diet Assoc. 1987. – Vol. 87, №7. – P. 928-930.
Наносрібло
Властивості срібла.Срібло – один із найбільш дефіцитних елементів в природі. Його вміст в земній корі близько 7 х 10-6 % маси. Більша частина срібла (близько 80%) отримують із поліметалічних руд, а також із руд, де міститься золото та мідь. Срібло - благородний метал, стійкий проти корозії. Чисте срібло білого кольору, м’яке, ковке. Питома вага 10,5 г/см3, температура плавлення 960,5 С, близьке за цими властивостями до золота та міді. Найкраще серед металів проводить тепло та електричний струм. Срібло розчиняється лише у таких кислотах, які є окислювачами (азотна кислота, гаряча концентрована сірчана кислота та ін.). У хімічних сполуках срібло, як правило, одновалентне. При дії лугів на солі срібла утворюється гідрат закису, який легко відщепляє воду, утворюючи закис срібла Ag2O [Klasen H. J. Et al 2000], [Lok C.N. et al, 2007], [C. Carlson et al, 2008]. Під дією світла такі сполуки розпадаються, виділяючи металеве срібло. На цьому явищі ґрунтується фотографічний процес. При дії аміаку з срібла утворюються розчинні у воді комплексні сполуки [Максимов М.М., 1981], [А.В. Бгатов, 1999], [E. J. Rentz 2003], [Ki-Young Yoon at al., 2007].
Вплив препаратів срібла на організм людини.Срібло — важливий для організму мікроелемент, необхідний для нормального функціонування залоз внутрішньої секреції, мозку, печінки та інших органів. Однак срібло відноситься до важких металів, може проявляти і негативну дію на організм людини. При прийомі 2 г солей срібла виникають токсичні прояви, а при дозі в 10 г вірогідна смерть. Крім того, при застосуванні срібла протягом декількох місяців можливе накопичення металу в організмі з розвитком токсичної реакції [Войнар А.И, 1960; V. Alt et al, 2004].
Висока біологічна активність мікроелементів-металів в організмі пов’язана, перед усім, з участю їх у синтезі деяких ферментів, вітамінів та гормонів. В залежності від концентрації катіони срібла можуть як стимулювати, так і пригнічувати активність деяких ферментів. Під впливом срібла в два рази посилюється інтенсивність окислювального фосфорилювання в мітохондріях головного мозку, а також збільшується вміст нуклеїнових кислот, що покращує функцію центральної нервової системи. Підвищення концентрації іонів срібла до 0,01 мкг знижує ступінь поглинання кисню клітками цих органів, що свідчить про участь катіонів срібла в регуляції енергетичного обміну. При інкубації різних тканин у фізіологічному розчині, що містить 0,001 мкг катіона срібла, зростає поглинання кисню мозковою тканиною на 24%, міокардом – на 20%, печінкою – на 36%, нирками – на 25% [Войнар А.И., 1960].
Вплив срібла на обмін речовин в організмі. Мікроелементи-метали в організмі приймають участь в регуляції обміну речовин, функції деяких ферментів, вітамінів і гормонів. У добовому раціоні людини в середньому має міститися біля 80-90 мкгсрібла. В організмі тварин і людини вміст срібла складає 20 мкг на 100 г сухої речовини. Найбільш багаті сріблом мозок, залози внутрішньої секреції, печінка, нирки та кістки скелету. По зменшенню кількості срібла органи людини можна розмістити у такій послідовності:мозг, залози внутрішньої секреції, печінка, нирки і кістки. В залежності від концентрації катіони цього металу можуть як стимулювати, так і пригнічувати активність деяких ферментів. Під впливом солей даного металу в два рази підвищується інтенсивність окисного фосфорилювання в мітохондріях головного мозку, а також збільшується вміст нуклеїнових кислот. Зростає поглинання кисню мозковою тканиною на 24%, міокардом – на 20%, печінкою – на 36%, нирками – на 25% при інкубації у фізіологічному розчині, що містить 0,001 мкг катіону срібла. При підвищенніконцентрації іонів срібладо 0,01 мкг понижується інтенсивність поглинання кисню клітинами цих органів. Це свідчить про плив катіонів срібла в регуляції енергетичного обміну в організмі [Eric J. Rentz et al, 2003; Chen X, Schluesener H.J. et al, 2008; Braydch-Stolle, Hogstrand C.].
Дози срібла50-250 мкг/л при тривалому застосуванні є фізіологічними і не викликають негативної дії на організм. Патогістологічні дослідження на тваринах, які отримували з питною водою срібло в дозах, що значно перевищували гранично допустимі (20000-50000 мкг/л), показали, що при тривалому застосуванні та у великих дозах іонів срібла має місценакопичення цього металу в тканинах організму. Тривале споживання людиною питної води, що містила 50 мкг/л срібла (рівень ПДК), не впливає від’ємно на функції органів травлення, в тому числі і на антитоксичну функцію печінки. При тривалій роботі зі сполуками срібла у виробничих умовах може призводити до відкладення цього металу в шкірі та зміні її кольору – аргірії („колір загару”), що є наслідком фотохімічного відновлення іонів срібла. При обстеженні хворих з явищами аргірії не відмічено змін у функції і обміні речовин органів і систем організму. Крім того у цих людей з признаками аргірії мала місце підвищена стійкість до більшості вірусних та бактеріальних інфекцій. [Зак В.И., 7,Statchounski; Williams J.D; Woraz K. 30, 31, 32].
Срібло є ефективним імуномодулятором, призводить до підвищення кількість імуноглобулінів та Т-лімфоцитів [Риткер П.]. При вивченні впливу препаратів срібла на організм людини відмічена його стимулююча дія на кровотворні органи, що виявляється в зникненні молодих форм нейтрофілів, збільшенні кількості лімфоцитів і моноцитів, еритроцитів і гемоглобіну, уповільненні ШОЕ. Таким чином, в світлі сучасних уявлень, срібло розглядається як мікроелемент, необхідний для нормального функціонування внутрішніх органів і систем, а також як сильнодіючий засіб, що підвищує імунітет і що негативно впливає на хвороботворні бактерії і віруси [Becker R.O. Et al, 1999], [Е.Родимин 2003], [Sukdeb Pal et al., 2007].
Дія колоїдного срібла на мікроорганізми.
Значний внесок у вивчення протимікробних властивостей срібної води, її застосування для знезараження питної води та харчових продуктів вніс академік НАН України Л.А. Кульский. Його експериментами, а пізніше і роботами інших дослідників, доведено, що саме іони металів і їх диссоційовані з'єднання (речовини, здатні у воді розпадатися на іони) проявляють бактерицидну дію, викликаючи загибель мікроорганізмів. У всіх випадках протимікробний ефект срібла більш виражений, чим вища концентрація іонів срібла. При вживанні допустимих концентрацій, срібна вода, викликаючи загибель патогенної і умовно-патогенної флори організму та не впливає на сапрофітну флору організму [Потапченко Н.Г., Кульський Л.А., 1985], [Кульский Л.А., 1977]. Бактеріоцидна дія іонів срібла залежить від концентрації цього металу[9] і перевищує такі сполуки як фенол, сулема і препаратів хлору. Спектр протимікробної дії срібла значно перевищує антибіотики і сульфаніламіди, впливаючи антибіотикостійкі штами [Березняков; Потапченко Н.Г. 1, 14].
Найбільш вираженою бактерицидною дією володіє срібло, меншим – мідь і золото. Експериментально це доведено на дифтерійній паличці, яка гинула на срібній пластинці через три дні, на мідній – через шість днів, на золотій – через вісім. Стафілокок гинув на сріблі через два дні, на міді через три, на золоті – через дев'ять днів. Тифозна паличка на сріблі і міді гинула через 18 год, а на золоті – через шість – сім днів [Harris L.G. et al, 2003].
Протимікробна дія срібла зумовлена тим, що відбуваєтьсявзаємодія електростатичних силмікробної клітини, які мають від’ємнийзаряд, і позитивно запряженими іонами срібла [Williams JD; Woraz K.31, 32]. Має місце утворення комплексів нуклеїнових кислот зі сріблом, що порушує стабільність ДНК і життєздатність мікроорганізмів [Soni I;29]. Не виключено, що одним із механізмів протимікробної дії іонів срібла є пригніченнятрансмембранного транспорту Nа+ и Cа++[Dowson C.25].
Препаратисрібла, що застосовуються у медичній практиці.Фармакологічні та фармацевтичні властивості препаратів срібла вивчали вчені багатьох країн світу [Кульский Л.А., 1977;Маяковський; Чекман; Becker R.O. еt al, 1999]. Безбарвні прозорі кристали у вигляді пластинок або білих кристалічних паличок без запаху. Дуже легко розчиняється у воді (1:О,6) та менше в спирті (1:30). Під дією світла темніє. Несумісний з органічними речовинами (розкладається), з хлоридами, бромідами, йодидами (утворюється осад). У невеликих концентраціях, срібла нітрат проявляє протизапальну дію, в міцніших розчинах припікає тканини. Володіє бактерицидними властивостями. Застосовують зовнішньо при ерозіях, виразках, надлишкових грануляціях, тріщинах, при гострому кон'юнктивіті, трахомі, при хронічному гіперпластичному ларингіті і тому подібне. Призначають у вигляді водних розчинів, мазей, а також у вигляді ляпісних олівців. Зовнішньо для змащування шкіри і для припікань застосовують 2 - 10 % розчин, 1 - 2 % мазь; для змащування слизових оболонок – 0,25 - 2 % розчин. Олівець ляпісний (Stillius Argenti nitratis, Stillius Lapidis) – тверда біла або сірувато-біла паличка конічної форми із закругленою вершиною. Містить 0,18 г срібла нітрату. Застосовують для припікань. Розчином (2 %) срібла нітрату раніше широко користувалися для профілактики бленореї у новонароджених.
Коларгол (колоїдне срібло)– зеленовато- або синювато-чорні лусочки з металевим блиском, у воді утворюють колоїдний розчин. У 1902 німецький хімік Карл Пааль розробив спосіб захисту частинок срібла шляхом утворення якнайтоншої оболонки з білка альбуміну, який міститься в курячому яйці. Тоді частинки срібла не злипатимуться. Коларгол містить до 70% срібла. Застосовуються у вигляді розчинів для промивання гнійних ран, сечового міхура при циститах і уретритах, очей (у вигляді крапель) при кон'юнктивітах і тому подібне. Інколи застосовують у вигляді мазі при бешихових запаленнях та ін.
Протаргол (Protargolum, Argentum proteinicum). Коричнево-жовтий або коричневий легкий порошок без запаху, слабко гіркого і злегка терпкого смаку. Легко розчинний у воді, нерозчинний в спирті, ефірі, хлороформі. Містить 7,8 - 8,3 % срібла. Застосовують як антисептичний і протизапальний засіб для змащування слизових оболонок верхніх дихальних шляхів (1 - 5 % розчин), для промивання сечовивідного каналу і сечового міхура при гонорейному хронічному уретриті (1 - 3 % розчин), в очних краплях при кон'юнктивіті, блефариті, бленореї (1 - 3 % розчин). У зв'язку з наявністю сучасних антибактеріальних препаратів (сульфаніламіди, антибіотики і ін.), протаргол, як і інші препарати срібла, широкого вживання в даний час не має.
Отримання наночастинок срібла.Розроблені декілька методів отримання частинок нанометалів. Фізичні – подрібнення масивної речовини до часток відповідних розмірів. Хімічні методи основані на відновленні іонів металів до атомів у розчині [Yamamoto T. et al., 2000; Кузьмина Л.Н., Звиденцова Н.С., 2007].
Речовина у наностані надзвичайно реакційно активна, оскільки володіє великою питомою поверхневою енергією. Тому наночастинки легко можуть агрегувати один з одним, взаємодіяти з тими або іншими речовинами в зовнішньому середовищі, руйнуватися, окислюватися і так далі. Існують різні варіанти хімічного синтезу, що розрізняються типом відновника, способом стабілізації наночастинок та іншими особливостями [Сергеев Г.Б. 2006; S. Kyriakou et al., 2003; Haizhen Huang et al., 2004],
Наприклад, використовуєтьсятехнологія, яка називається метод біохімічного синтезу наночастинок металів в зворотних міцелах. Дана технологія використовує загальний принцип хімічних методів – відновлення іонів металів в розчині з подальшою агрегацією атомів і іонів з утворенням наночастинок. Формування наночастинок за такого методу відбувається у внутрішньому середовищі зворотної міцели. Зворотна міцела – це дуже маленька бульбашка, оболонка якої утворена молекулами поверхнево-активної речовини (полярні голівки всередину, неполярні хвости назовні), а усередині (у водному ядрі) знаходяться вода і іони металу [Мовчан Б.А., 2008; Федоров І. 2005; Nadanathangam Vigneshwaran, 2007; [Kalishwaralal Kalimuthu. 2008].
В порівнянні з іншими хімічними методами метод біохімічного синтезу наночастинок металів в зворотних міцелах має переваги, перш за все, з точки зору практичного застосування металевих наночастинок. Крім того, для наночастинок срібла розроблена технологія отримання з розчинів міцел – водних розчинів, в яких наночастинки не втрачають своїх властивостей і продовжують залишатися стабільними в середньому близько півроку [Сергеев Б.М., Кирюхин М.В., 2001; Родимин., 2003; Evanoff D.D., 2005; Baker C., 2005].
Протимікробні властивості наносрібла.У нанорозмірному діапазоні практично будь-який матеріал проявляє своєрідні властивості, особливо такий метал як срібло. Іони срібла володіють антисептичною активністю. Наночастинки срібла розміром 10-30 нм спричинять виражений антибактеріальний ефект і застосовуються для місцевого лікування інфікованих ран шкіри [Hirsch L.R. et al.]. Встановлено, що розчини наносрібла є найефективнішим засобом при безпосередньому контакті з поверхнями, запаленими унаслідок бактерійного зараження [Волков С.В., Ковальчук С.П. та ін., 2008; Чекман І.С., Сердюк А.М, 2009; Chaw K.C. et al., 2005; Kim J.S., 2007]. Наночастинки срібла завдяки малому розміру та іншим фізико-хімічним властивостям надзвичайчайно активні і викликають загибель різних мікроорганізмів: бактерій, вірусів, патогенних грибків [Chen X. Schluesener 24]. Застосуваннясрібла у вигляді наночастинок дозволяє значно знизити у концентрацію срібла зі збереженням примікробних властивостей, в тому числі до мікроорганізмів стійких до антибіотиків [Alt V.21]. Комплекс наносрібла з імідазол циклофосфаном має таку ж протимикробну активність, як 0,5 % розчин срібла нітрат по відношенню до S. аureus, а также E. coli, P. aeruginosa, C. albicans, A. niger и S. cerevisiae. Гостра токсичність (ЛД50) цієї сполуки при внутрівенному введені щурам – 100 мг/кг [Melthus A.27].
Дата добавления: 2016-08-08; просмотров: 825;
