Asterita Mary Frances. (1987) Physical exercise, nutrition and stress. Praeger Publishers, 216 р.
36. Bonamigo R.R., Leite C.S., Wagner M., Bakos L. Rosacea and Helicobacter pylori: interference of systemic antibiotic in the study of possible association // J. Eur. Acad. Dermatol. Venereol. – 2000. – 14:424-425.
- Briand G.G., Burford N., Cameron T.S. et al. (1998) Defining and controlling the aminoethanethiolate chemistry of bismuth(III): Synthesis and comprehensive characterization of the homologous thiolatobismuth series. J. Am. Chem. Soc.,120: 11374-11379.
- Greenwood N.N., Earnshaw A. Chemistry of the elements ( 1997). 2nd edn. Reed Educational and Professional Publishing Ltd., 553 р.
- Jia R. R., Wu C. P., Yang Y. X. et al. Preparation of new amino acid complex nanoparticles of bismuth and leucine // Nano Lett. – 2005. – Vol. 28. – P. 409–412.
- Kopf-Mair P., Klapotka T. Antitumor activity of some organome-tallic bismuth(III) thiolates // Inorg. Chem. Acta. – 1988. – Vol. 152. – P. 49–52.
- Lambert.J.R. Pharmacology of bismuth-contaning compounds // Rev. Infect.Dis. – 1991. – Vol. 13, (Suppl. 8). – P. 691–695.
- Li Y., Wang J., Deng Z., Wu Y. et al. Bismuth nanotubes: a. rational low-temperature synthetic ronte // J. Am. Chem. Soc. – 2001. – Vol. 123. – P. 9904 – 9905.
- Megraud F. Basis for the management of Drug-resistant Helicobacter pylori infection // Drugs. – 2004. – Vol. 64. – 1893–1904.
44. Rebora A., Drago F. Helicobacter pylori and rosacea // J. Eur. Acad. Dermatol. Venereol. – 2000. – Vol. 43, №5. – Р. 884.
Наномагній
Характерною рисою науки
Є якраз те, що потребує
активної діяльності.”
І.І. Мечніков (1845–1916),
Російський вчений,
Лауреат Нобелівської премії
Наномагній
Історія відкриття магнію.Історіявідкриття магнію, який потім назвали англійською або гіркою сіллю, почалася з 1625 року, коли англійський вчений Д. Гро отримав речовину шляхом випаровування мінеральної води епсомського джерела. Такий же порошок отримували при прокалюванні металу, знайденого біля міста Магнезії. Отримана сполука була подібна гірській солі і отримала назву магнезія. Шотландський вчений з Единбургу Д. Блек в 1755 році довів існування індивідуального елементу з властивостями білої магнезії і назвав його магнієм. Чистий магній отримав спочатку Г. Деві у 1808 році, а пізніше А. Бюссі в 1829 році [17].
Магній – це регулятор біохімічних та фізіологічних процесів в організмі, належить до 12 структурних елементів, які становлять 99% елементного складу організму людини. Оскільки цей елемент є одним із основних внутрішньоклітинних іонів, бере участь у вуглеводному, білковому, ліпідному обмінах [Андріанова і спів.; Коломієць; ЧекманНіколай4,10, 18]. Іон Mg2+ знаходиться на четвертому місці по знаходженню його кількості в організмі людини після натрію, калію та кальцію. Важливий для здійснення транскрипції ДНК, а також при підтриманні стабільності РНК. Процеси транспорту Mg2+ регулюються гормонами (наприклад, антидіуретичними пептидами, глюкогоном, кальцитоніном, інсуліном) [Торшин15].
Фармакокінетика магнію.Всмоктування магнію відбувається в три етапи. Перший етап – це абсорбція, тобто всмоктування Mg2+ у кишечнику та у дванадцятипалій кишці. Магній засвоюється відносно добре (30-35% з харчових продуктів). Покращують всмоктування магнію вітамін В6, молочна та аспарагінова кислоти. Молоко та молочні продукти, що містять казеїн, теж сприятливо впливають на абсорбцію магнію. Другим етапом фармакокінетики є розподіл магнію в організмі. Загальна кількість магнію в дорослому організмі може складати в середньому 24-25 г (близько 1000 ммоль). Концентрація в клітинах становить 5-10 ммоль/л, а в сироватці крові в нормі – 0,75-0,95 ммоль/л. Завдяки неоднорідності його розподілу в різних структурах тканин дані можуть помітно відрізнятися (наприклад, в еритроцитах – 2-2,5 ммоль/л). Третій етап–цеелімінація.Mg++ з організму виділяється головним чином нирками. За добу нирками виділяється близько 100 мг. В звичайному стані незначна кількість виводиться з потом. Люди, які підлягають значним фізичним навантаженням, з потом втрачають більшу кількість магнію. При суттєвому підвищенні температури повітря або збільшенні фізичного навантаження втрати магнію в процесі потовиділення можуть складати близько 15% всієї його кількості. У таких випадках поповнити втрати у пацієнтів можна лише за допомогою препаратів, що містять магній, або спеціальної дієти [Горецький; Watkins7, 50].
Магнієвий дефіцит буває первинним та вторинним. Первинний або конституційний, латентний, проявляється спазмофілією. Такий дефіцит може бути не пов’язаним із вмістом магнію в крові. Причиною є порушення трансмембранного обміну. Вторинний дефіцит магнію – це дефіцит, причиною якого є умови життя та хвороби людини. Найпоширенішими причинами порушень є такі фактори: гіпокалорійні дієти, що використовують з метою зниження ваги; стрес, особливо такий, що став хронічним; гіподинамія; вплив високих температур (сауни, бані, жаркий клімат, гарячі цехи тощо); гіперкальціємія; вагітність і лактація; діуретична, глюкокортикоїдна терапія; гормональна контрацепція; гіперглікемія; інфаркт міокарду тощо [Горецький; Межевитинова 7, 13]
З харчовими продуктами не завжди у організм надходить достатня кількість магнію, тому рекомендують щоденно вживати такі продукти та пити напої: коренеплоди, ягоди, злаки, фруктові соки, мінеральні води і т.п. Розрахунки добової норми вмісту вживання магнію залежать також від віку. Організм дитини, який в період росту активно формується, потребує багато енергії, адже повинен забезпечуватися всіма необхідними корисними компонентами харчування. Людям похилого віку доцільно складати раціон з урахуванням потреб організму індивідуально, тому що зі старінням організм засвоює меншу кількість магнію з їжею. Потреба в магнії зростає у вагітних жінок, годуючих матерів, хворих на вірусні та бактеріальні захворювання і спортсменів [Горецький; Кулиенков; ЧекманБеленічев7, 12, 17]. Відомо також, що гіпомагнезія спостерігається у хворих на цукровий діабет 2-го типу. Тому пацієнтам показані препарати магнію, які комбіновані з вітаміном В6. Це дозволяє стабілізувати рівень глюкози в крові, тим самим поліпшивши стан хворого. Застосування препаратів магнію протягом 2 тижня І, ІІ та ІІІ триместрів вагітності сприяє зниженню частоти випадків гіпоксії плоду при родах, підвищує імунітет вагітних жінок до ОРЗ [Кошелева11].
Таблиця 1.
Норми фізіологічної потреби в магнії[Скальний14].
| Вік, фізіологічний стан | Норма фізіологічної потреби, мг на добу |
| 0-3 міс | 55,0 |
| 4-6 міс | 60,0 |
| 7-12 міс | 70,0 |
| 1-3 року | 150,0 |
| 4-6 років | 200,0 |
| 6 років (школярі) | 250,0 |
| 7-10 років | 250,0 |
| 11-13 років | 300,0 |
| 14-17 років | 300,0 |
| Понад 17 років | 400,0 |
| Вагітні жінки й жінки, що годують | 450,0 |
Клінічні прояви дефіциту магнію виявляються порушенням синтезу інсуліну, інсулінорезистентністю, підвищенням функції щитовидної залози, підвищеним виділенням катехоламінів (ендокринно-обмінні процеси); вегетативною дисфункцією, синдромом хронічної втоми, запамороченнями, головним болем, а також тривогою, необґрунтованими страхами, депресією, галюцинаціями тощо (психічні та неврологічні процеси); розвитком атеросклерозу, артеріальної гіпертензії, тахікардією, аритмією [Школьников21].
Даний біометал знижує збудження в нервових клітинах, розслаблює серцевий м’яз [ГорчаковаТкачук8], регулює функцію нервової, серцево-судинної, кістково-м‘язової системи, шлунково-кишкового тракту та ін. [Боброва; Боброва; 5,6]. Препаратам магнію властива мембраностабілізуюча дія, наслідком чого є виражене пригнічення функції нервової системи, що призводить до зменшення тривоги, стабілізації психологічного стану, заспокоєння та до врівноваження реакції на зовнішні подразники. Магній відіграє особливе значення у реалізації біохімічних процесів, так як є природним антагоністом кальцію [Андреев3]. Магній взаємодіє з кальцієм на рівні мембран та безпосередньо може впливати на їх збудливість [Resnick 43]. Солі магнію пригнічують функцію ЦНС, проявляють антиішемічний, гіпотензивний, діуретичний ефекти. Найпоширенішими лікарськими формами магнієвмісних препаратів є таблетовані препарати та препарати, які використовують для парентерального введення.
Обстежені хворі зі встановленим діагнозом дефіцит магнію, що клінічно проявлявся астено-невротичним синдромом, яким призначали препарат Магне В6. Після застосування Магне В6 самопочуття пацієнтів поліпшилося і не спостерігалося швидкої втомлюваності, запаморочення, головного болю, що стверджувало підвищення адаптаційних можливостей організму [Акарачкова; Акарачкова1, 2].
Магній є кофактором багатьох ферментативних реакцій, проявляючи позитивну дію безпосередньо чи опосередковано. Завдяки властивості вступати у зв’язки з органічними речовинами магній приймає участь у таких реакціях як креатинінфосфокіназа, Са-АТФ-аза, ферментів білкового синтезу, гліколізу та ін. Магній бере участь у метаболічних процесах, регулює фосфорний, білковий і вуглеводний обміни, знижує збудливість нейронів та пригнічує передачу нервового імпульсу, стимулює розпад нуклеїнових кислот. Магній сприяє адаптуванню організму до холоду; цей елемент є структурним компонентом кісток та зубної емалі (до 53 %), 20 % знаходиться в серці, м’язах, печінці, нирках і лише 10 % поза клітинами [Акарачкова; Торшин; ЧекманБеленичев1, 15, 17].
Препарати магнію нормалізують артеріальний тиск, знімають спазми судин, тому в них виражена спазмолітична та судинорозширювальна дія. У пацієнтів з ураженням ЦНС та інших життєво важливих систем, коли спостерігається дефіцит магнію і необхідне лікування патологічного стану, застосування препаратів магнію є необхідною складовою [Боброва;Gueux6, 28].
Експериментальні вивчення молекулярних механізмів регулювання обміну речовин повинні включати в себе аналіз ультраструктурних змін, що викликані дефіцитом Mg3+/Ca2+, аналіз відношення між активністю матричних металопротеіназ та Mg2+ in vitro й in vivo. Такі медикаменти виявляють мембраностабілізуючу, антиоксидантну, антиаритмічну дію. В умовах ішемії та гіпоксії одним із механізмів впливу препаратів на клітини є пригнічення процесів відьнорадикального окислення білків і перекисного окиснення ліпідів. Протиаритмічна дія магнію широко використовується, адже про неї добре відомо. Препарати доцільно використовувати при: шлуночковій тахікардії; шлуночкових аритміях; суправентрикулярній пароксизмальній тахікардії тощо. Завдяки зазначеній дії та вмісту іонів магнію препарати потенціюють клінічну ефективність протиаритмічних засобів та виявляють антиаритмічну дію. При станах, пов’язаних з активацією вільно-радикальних реакцій, застосування препаратів супроводжується зменшенням проникності клітинних мембран [Аракова, БоброваГорецький2, 6, 7].
Біодоступність магнію регулюється генами, серед яких є такі, як TRPM6 та TRPM7, що найголовніші для даного явища. Білок TRPM6 (transient receptor potential cation channel 6) – це іонний канал, що транспортує двовалентні катіони і разом з іншим каналом TRPM7 (transient receptor potential cation channel7) утворює функціональні комплекси на поверхні клітини. Під впливом протеінкінази, яка активується катехоламінами, чутливість TRPM7 до іонів магнію зростає. Це спричиняє закупорення каналів клітини, в свою чергу викликаючи дефіцит магнію. Ген CASR (утворюється в прищитовидній залозі та ниркових канальцях) діє як сенсор, що реагує на концентрацію катіонів за рахунок високої чутливості, відіграє важливу роль в підтриманні катіонного гомеостазу. Дефекти, що можуть виникати в цьому гені, викликані гіпер- або гіпокальціємією. Активація CASR Ca2+/Mg2+-чутливого рецептора понижує активність білкової кінази А (РКА). Внаслідок цього впливу зменшується фосфорилювання клаудина-16 в лізосоми. Результатом цього явища є зменшення реабсорбції магнію в ниркових канальцях [Торшин15].
Наномагній.Наночастинки магнію проявляють специфічні властивості, що частково пояснюється їх поверхневою активністю, зарядом атомів, структурою молекули. Це зумовлює легку їх проникність через мембрани тканин. Наноматеріали можна застосовувати в якості речовин для створення лікарських засобів з метою зменшення негативних ефектів медикаментів та діагностики хвороб [Гусев; Чекман; BaptistaThaxton9, 16, 22, 49].
Для кожної наночастинки характерним є діапазон активності, що зумовлений її розмірами. Малі частинки з розмірами близько 5-15 нм активніше вступають в реакцію з оточуючим середовищем. Наномагній зі збільшенням/зменшенням розмірів змінює свої фармакотерапевтичні властивості. Під час дослідів це потрібно враховувати, адже навіть з незначними різницями розмірів результат може суттєво відрізнятися. Для медичного застосування й випробовування ефективними є нанострижні (nanorods) з довжиною 17-70 нм. Наносфери та наноскоринки, що мають округлу форму, доцільно використовувати діаметром 30-40 нм [Ge Y; Huang X; Rosenberg 26, 34, 45].
Експериментальних досліджень з препаратами наномагнію недостатньо, в той час коли наноструктурований магній активно використовують в розробках нових речовин з певними властивостями для промисловості. Можливо це пояснюється комерційною зацікавленістю компаній створенням нової техніки та промислової продукції. Звертається увага на агрегатну стійкість щодо атмосферного впливу, агресивних хімічних середовищ тощо.
Заслуговують на увагу наногетероструктури магнію та цинку, в яких хімічна модуляція поширюється радіально. Виявлені відмінності в інтенсивності випромінювання в ядрі та на поверхні оболонки. Ці досліди важливі для розвитку майбутньої наноінженерії, що повинна інтегруватися в розвиток нових функціональних нанопристроїв [Rosenberg45].
Наномагнію, як і деяким іншим наночастинкам, притаманне пасивне накопичення у ділянці злоякісної пухлини (пасивний таргетинг). Це обумовлено захопленням їх макрофагами і так званим ефектом підвищеної проникності і накопичення, який є проявом недосконалості судинної системи злоякісних пухлин, що швидко розвиваються [Maeda; Moore; Zimmer; 39, 40, 56].
Як відомо, наномагній має специфічні оптичні властивості. В залежності від коливань електронів та частоти хвилі падаючого світла деякі промені можуть поглинатися, інші відбиватися. Саме на цьому методі ґрунтуються дослідження для діагностики захворювань. Наприклад, тканина, що складається з ракових клітин за рахунок патологічного ділення ущільнюється, тому її структура відрізняється від структури функціонально однакових клітин. Наночастинки здатні відбивати світло з інтенсивністю, що на порядки перевищує інтенсивність випромінювання багатьох відомих барвників, які використовуються у діагностичних цілях. При цьому на відміну від останніх, не спостерігається ефекту знебарвлення [Sonnichsen47]. Це, наприклад, зумовлює колір забарвлення та його інтенсивність в колоїдних розчинах наночастинок золота (червоне,фіолетове, блакитне). Забарвлення розчину залежить від багатьох факторів, таких, наприклад, як метод отримання частинки наномагнію. В той же час наночастинки магнію активно поглинають хвилі з певною довжиною. Відбувається перетворення енергії світла у теплову. Довжина хвилі, при якій спостерігають поверхневий плазмоновий резонанс, значно залежить від форми, розмірів та хімічної властивості наноелементів [Huang X; Jain PK; 34, 35]. Явище поверхневого плазмонового резонансу лежить в основі нової методики діагностики та лікування злоякісних пухлин. Наномагній можна використовувати як контрастний агент. Наприклад, хвора ділянка органа насичується такими частинками і дещо змінює своє забарвлення [Huang X,El-Sayed; Huang X,El-Sayed; 32, 33].
Кластери двохвалентного магнію та кальцію використовують якнанокалориметри для вимірювання внутрішньої енергії, що знаходиться в обраній ділянці при захопленні теплових електронів. Результатом активації цих груп є інфрачервоне випромінювання на поверхні вакуумної камери, а також від нагрітого катода. Зіткнення електронів відбуваються при їх низьких енергіях. Спостерігаються різні способи дисоціації двохвалентних кластерів магнію та кальцію [Coon J; Syka 23, 48].
Головною проблемою є розробка йстворення ефективних й безпечних матеріалів для зберігання водню. Магній та його сплави розглядається як перспективний метал, що може використовуватися для практичного зберігання водню по причині низької собівартості та високої продуктивності. При застосуванні даних матеріалів необхідно вирішити ряд проблем, що пов’язані з температурою плавлення, структурою, ємністю. При цьому не менш важливо те, щоб такий матеріал, вступаючи в реакції, не виділяв побічних речовин як всередину, де проходять реакції, так і назовні. Адже такі прилади спрямовані на роботу з людьми, а гази, пар і т. п. можуть бути небезпечними для людського організму. З появою наноструктурованих речовин завдання полегшилося. Почалися активні розробки нового економічно вигідного, безпечного, якісного матеріалу для зберігання водню. Таким чином, стало можливим надавати нових властивостей звичним матеріалам, при цьому помітно поліпшивши характеристики, що залежать від температури та хімічних реакцій, які відбуваються під час плавлення. Крім того, за участю наноструктурованого магнію можуть бути леговані інші металічні матеріали, наприклад, такі як нікель. Ванадій і залізо виявилися не досить зручними та надійними. Нещодавно синтезовані матеріали вуглеводів: вуглеводні нанотрубки, які мали інший вплив на зберігання водню в сплавах магнію за рахунок підвищення дифузії водню в системах Mg2H2-C [Xiangdong53].
Нанобіотехнології можуть суттєво поліпшити якість доставки до патологічного процесу важко розчинних у воді лікарських засобів, переносити наркотики через мембрану клітин [LaVan D;36], а також через епітеліальні та ендотеліальні бар’єри [Ferrari25], використовувати комбіновану терапію (з двох або більше препаратів) [Zhang; 54]. Іони магнію необхідні для стабілізації РНК. Mg2+ стабілізує структуру транспортної РНК. Дефіцит магнію призводить до часткової дисоціації (розпаду) РНК, сповільнює синтез білка, що, в свою чергу, впливає на синтез структурних молекул, наприклад, колагенів, еластинів тощо [Торшин 15]. Наномагній належить до біосумісних матеріалів [GuF; ZhangN27, 55].
Вибір лікарських засобів для цілеспрямованої доставки речовини в клітину вимагає ретельного вивчення. Поверхня тканин організму сприяє проникненню та міжтканинному і міжклітинному поглинанню лікарських препаратів, що дозволяє значно впливати на терапевтичну ефективність і вивчити вплив наноструктурованих частинок магнію на організм [Omid 41].
Іони магнію можуть осідати на негативно заряджених ланцюжках полісахаридів, приєднаних до протеогліконів [Торшин 15]. У деяких випадках біомолекули приєднуються до поверхні наночастинок (в залежності від властивостей) шляхом електростатичних, гідрофільних та гідрофобних взаємодій або хімічного синтезу чи генно-інженерними методами [HuangX34]. Хоча щільна функціоналізація молекулами ДНК пов’язана із низкою труднощів, шляхом застосування наночастинки 2 нм вдалося досягти певного успіху. Гібридизація з комплементарними послідовностями призводить до агрегації наночастинок. Це супроводжується зміною забарвлення, що реєструються спектрофотометрично. При незначних концентраціях ДНК, що визначається порядку 1·10-15 моль, можливе застосування „срібного підсилення” [HanX; HouS-Y; Thaxton29, 30, 49].
Методика, заснована на агрегації наночастинок, має ще одну перевагу: інтервал температури плавлення (тобто температури, при якій комплементарні зв’язки розриваються) гібридизованих ДНК стає невеликим. Розрив комплементарних зв’язків відбувається стрибкоподібно, змінюються й оптичні властивості розчину (зміна кольору: довжини хвилі, при якій спостерігається максимальне оптичне поглинання). При цьому, сама температура плавлення значно залежить від комплементарності. Виявляються неспівпадання одного або кількох нуклеотидів. Метод, що заснований на використанні наночастинок магнію, є перспективним для застосування в клінічній практиці, так як дозволить виявляти збудники вірусних хвороб, злоякісні новоутворення на ранніх стадіях розвитку з проведенням ефективного лікування без використання складних методик і дорогого обладнання [DingY24].
Наномагній використовують у дослідах зі зниженням температури розпаду ДНК, тобто її денатурації. Нанокластери амінопропілфункціоналізованого магнію філосілікату (phyllosilicate) були підготовлені у воді за допомогою пілінгу. Пілінг – це поверхневе очищення зовнішніх шарів покриву частинки для покращення якості хімічних реакцій. Для підготовки досліду використовували нанокластери в якості блоків на основі ДНК-гібридної структури, впорядкованих нанокомпозитів або витягнутої нанопроволоки. Нанопроводи складаються з ізольованих молекул ДНК-м або плазмідів ДНК, що вкриті ультратонким шаром органічного клею. Цей шар виконує функцію захисної оболонки. Нанокомпозити мають в своєму складі вставні моношари молекули ДНК порівняно невеликої довжини (700 пар нуклеотидів). Теплова стабілізація біомолекул суттєво обмежена, тому шар органічного клею може бути корисним агентом для підвищення хімічної, термічної і механічної стабільності нанопотенціалу блоків молекул ДНК [PatilA; 42].
На основі вище описаних дослідів можна зробити висновок, що наномагній проявляє різноманітні властивості, тому привертає увагу дослідників [LiongM; RuhlandNh; Weissleder; ZindargR;38, 46, 51, 57].
Заключення.Магній широко використовують як ефективний засіб для лікування хвороб та профілактики захворювань, забезпечення нормальної розумової та психологічної діяльності. Магній та наномагній – це не тільки сировина для розробок лікарських препаратів та речовин з новими властивостями, але і основа для застосування у різних галузях діяльності людини. Наномагнію притаманні своєрідні властивості, що дають можливість синтезувати нові сполуки. Токсичність наномагнію залежить від розмірів частинки. Застосування препаратів наномагнію може мати місце у виготовленні лікарських засобів після детального вивчення впливу на організм. Не зважаючи на те, що ведуться активні дослідження даної речовини, не достатньо вивчено вплив наночастинок магнію на організм тварини і людини, а також зовнішнє середовище.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Акарачкова Е.С. Дефицит магния: клиника, диагностика, терапия // Фарматека. – 2007. – Т. 20. – С. 25 –30.
2. Акарачкова Е.С. Оценка эффективности применения Магне В6 у пациентов с клиническими проявлениями стресса // Трудный пациент. – 2008. – Т.6, № 2-3. – С. 43-46.
3. Андреев Н.А., Моисеев В.С. Антагонисты кальция в клинической медицине. – М.: Фарммедио, 1995. – 158 с.
4. Андрианова М.Ю., Дементьева И.И., Мальцева А.Ю. Магний и его баланс (обзор литературы) // Анестезиология и реаниматология. – 1995. – №6. – С. 73-76.
5. Боброва Е.В. Кишечная абсорбация магния и антигипертензивная эффективность антагонистов кальция // Укр. кардіол. журн. – 1999. – №2. – С. 35-338.
6. Боброва Е.В. Регуляция обмена магния при эссенциальной гипертензии // Укр. кардіол. журн. – 1997. – N.4, вып. 2. – С. 56-59.
7. Горецкий В.В., Талибов О.Б. Препараты магния в медицинской практике. Малая энциклопедия магния. – М.: Медпрактика-М, 2007. – 44 с.
8. Горчакова Н.А., Ткачук В.В. Влияние сердечних гликозидов и никотинамида на содержание кальция и магния в миокарде и печени крыс при гемической гипоксии // Фармакология и токсикология: Сборник научных трудов. – К.: Здоров’я, 1986. – С. 35-37.
9. Гусев А. И. Наноматериалы, наноструктуры, нанотехнологии. – М.: ФИЗМАТЛИТ, 2-е изд., испр., 2007. – 416 с.
10. Коломиец В.В., Боброва Е.В., Пархоменко Т.А. и соавт. Диетическое потребление кальция, магния, фосфора и риск развития артериальной гипертензии // Укр. кардіол. журн. – 1995. – №1. – С. 80-84.
11. Кошелева Н.Г., Никологорская Е.В. Профилактика гипертензивных форм гестоза с помощью Магне-В6 при невынашивании беременности в анамнезе // Рос. вестн. акушера-гинеколога. – 2005. – №1. – С. 40-42.
12. Кулиненков О.С. Фармакология и физиология силы. – М.: Медпрессинформ, 2004. – 308 с.
13. Межевитинова Е.А., Акопян А.Н. Магнийдефицитные состояния в гинекологической практике: клиническая оценка и методы корекции // Вопросы гинекологии, акушерства и перинатологии. – 2007. – Т.4, № 91. – 98 с.
14. Скальный А.В. Магний, энергия жизни, уверенность, сила. – Мед. эксперт. пресс, 2004 – 104 с.
15. Торшин И.Ю., Громова О.А., Рудаков К.В. Систематический анализ молекулярних механизмов воздействия магния на дисплазии соединитильной ткани // Клиническая фармакология и фармакоэкономика. –2009. – №1. – С. 42, 43, 44, 48.
16. Чекман І.С. Нанофармакологія: експериментально-клінічний аспект // Лікарська справа. Врачебное дело. – 2008. – № 3–4. – С. 104-109.
17. Чекман І.С., Белєнічев І.Ф., Горчакова Н.А. і співав. Магнійвмісні препарати: фармакологічні властивості, застосування. – Запоріжжя, Київ: Вид-во ЗДМУ, 2007. – 124 с.
18. Чекман И.С., Горчакова Н.А., Николай С.Л. Магний в медицине. – Кишенев: Штиинца, 1992. – 102 с.
19. Чекман І.С., Каплинський С.П., Небесна Т.Ю. і співав. Фармакологічний, токсикологічний і клінічний аспекти наномедицини // Фармакологія та лікарська токсикологія. – 2008. – Т.4, №5. – С. 3-9.
20. Чекман І.С., Корнєйкова Я.М., Загородний М.І., Кардаш М.І.. Квантові мітки: клінічні та фармакологічні аспекти // Мистецтво лікування. – 2008. – Т.50, №4. – С. 72-74.
21. Школьникова М.А., Чупрова С.Н., Каменин А.А. и др.. Метаболизм магния и терапевтическое значение его препаратов. – М.: Изд. Медпрактика, 2004. – 28 с.
22. Baptista P., Pereira E., Eaton P. et al. Gold nanoparticles for the development of clinical diagnosis methods // Anal. Bioanal. Chem. – 2008. – Vol. 391. – P. 943-950.
23. Coon J. J., Shabanowitz J., Hunt, D. F. etal. Electron transfer dissociation of peptide anions // J. Am. Soc. Mass Spectrom. – 2005. – Vol. 16. – P. 880-882.
24. Ding Y., Liu J., Wang H. et al. A piezoelectric immunosensor for the detection of α-fetoprotein using an interface of gold/hydroxyapatite hybrid nanomaterial // Biomaterials. – 2007. – Vol. 28. – P. 2147-2154.
25. Ferrari M. Cancer nanotechnology: opportunities and challenges // Nat. Rev. Cancer. – 2005. – Vol. 5. – P. 161-171.
26. Ge Y., Lawhorn B. G., El Naggar M. et al. Top down characterization of larger proteins (45 kDa) by electron capture dissociation mass spectrometry // J. Am. Chem. Soc. – 2002. – Vol. 124.– P. 672-678.
27. Gu F., Zhang L., Teply B. A. et al. Precise engineering of targeted nanoparticles by using self-assembled biointegrated block copolymers // Proc. Natl. Acad. Sci. U.S.A. – 2008. – Vol. 105. – P. 2586-2591.
28. Gueux E., Azais-Braesco V., Bussiere V. Effect of magnesium deficiency on triacylglycerolrich lipoprotein and tissue susceptibility to peroxidation in relation to vitamin E content // Brit. J. Nutr. – 1996. – Vol. 74, N. 6. – P. 849-856.
29. Han X. M., Jin M., Breuker K. et al. Extending top-down mass spectrometry to proteins with masses greater than 200 kDa // Science. – 2006. – Vol. 314. – P. 109-112.
30. Hou S-Y., Chen H-K., Chen H-C. et al. Development of zeptomole and attomolar detection sensitivity of biotin-peptide using a dot-blot gold nanoparticle immunoassay // Anal. Chem. – 2007. – Vol. 79. – P. 980 – 985.
31. Hu J., Bando Y., Zhan J. et al. carbon nanotubes as nanoreactors for fabrication of single-crystalline Mg3N2 nanowires // Nano Letters. – 2006. – Vol. 6, № 6. – P. 1136-1140.
32. Huang X., El-Sayed I. H., Wan Q et al. Cancer cells assemble and align gold nanorods conjugated to antibodies to produce highly enhanced, sharp, and polarized surface raman spectra: a potential cancer diagnostic marker // Nano Let. – 2007. – Vol. 7, №6. – P. 1591-1597.
33. Huang X., El-Sayed I. H., Wan Q. et al. Cancer cell imaging and photothermal therapy in the near-infrared region by using gold nanorods // J. Am. Chem. Soc. – 2006. – Vol. 128, №6. – P. 2115-2120.
34. Huang X., Jain P. K., El-Sayed I. H. et al. Plasmonic photothermal therapy (PPTT) using gold nanoparticles // Lasers. Med. Sci. – 2008. – Vol. 23. – Р. 217-228.
35. Jain P. K., Lee K. S., El-Sayed I. H. et al. Calculated absorption and scattering properties of gold nanoparticles of different size, shape, and composition: applications in biological imaging and biomedicine // J. Phys. Chem. В. – 2006. – Vol. 110, №14. – Р. 7238-7248.
36. LaVan D. A.; McGuire, T.; Langer, R. Small-Scale Systems for in vivo Drug Delivery // Nat. Biotechnol. – 2003. – Vol. 21. – P. 1184-1191.
37. Lee J. S., Seferos D. S., Gilijohan D. A. et al. Thermodynamically controlled separation of polyvalent 2-nm gold nanoparticle-oligonucleotide conjugates // J. Am. Chem. Soc. – 2009. – Vol. 30, №16. – Р. 5430-5431.
38. Liong M., Lu J., Kovochich M. et al. Multifunctional inorganic nanoparticles for imaging, targeting, and drug delivery // ACS Nano. – 2008. – Vol.2. – P. 889-896.
39. Maeda H. The enhanced permeability and retention (EPR) effect in tumor vasculature: the key role of tumor-selective macromolecular drug targeting // Adv. Enzyme Regul. – 2001. – Vol. 41, №1. – P. 189-207.
40. Moore A., Marecos E., Bogdanov A. et al. Tumoraldistribution of long-circulating dextran-coated iron oxide nanoparticles in a rodent model // Radiology. – 2000. – Vol. 214. – P. 568-574.
41. Omid C. Farokhzad, Robert L. Impact of nanotechnology on drug delivery // Acsnano.Farokhzzad and Langer. – 2009. – Vol. 3, №.1. – P. 16-20.
42. Patil A.J., Li M., Dujardin Е., Mann S. Novel bioinorganic nanostructures based on mesolamellar intercalation or single-molecule wrapping of DNA using organoclay building blocks // Nano Letters. – 2007. – Vol. 7, № 9. – P. 2660-2665.
43. Resnick L.M. Cellular calcium and magnesium metabolism in pathophysiology and treatment of hypertension and related metabolic disordes // Am. J. Med. – 1992. – Vol. 93, № 2. – P. 11-20.
44. Resnick L.M. 1. Dicturbances of calcium and magnesium metabolism in essential hypertension; 2. Ionic disturbances of calcium and magnesium metabolism: in essential hypertension // Hypertension: pathophysiology, diagnosis and management – 1995. – 2-nd Edition, – Vol.1, № 2. – P. 1169-1191.
45. Rosenberg R.A., Shenoy G. K. Getting to the core of the problem: оrigin of the luminescence from (Mg,Zn) O heterostructured nanowires richard. – 2007. – Vol. 7, № 6. – Р. 1521-1525;
46. Ruhland Th., Simon D. Nielsen S.D., Holm P., Christensen C.H. Christensen nanoporous magnesium aluminometasilicate tablets for precise, controlled, and continuous dosing of chemical reagents and catalysts: applications in parallel solution-phase synthesis // J. Comb. Chem. – 2007. – Vol. 9. – P. 301-305.
47. Sönnichsen G., Alivisatos P. A. Gold nanorods as novel nonbleaching plasmon-based orientation sensors for polarized single-particle microscopy // Nano Let. – 2005.– Vol. 5, №2. – P. 301-304.
48. Syka J. E. P., Coon J. J., Schroeder M. J. et al. Peptide and protein sequence analysis by electron transfer dissociation mass spectrometry // Proc. Natl. Acad. Sci. U.S.A. – 2004. – Vol. 101. – P. 9528-9533.
49. Thaxton C. S., Georganopoulou D. G., Mirkin C. A. Gold nanoparticle probes for the detection of nucleic acid targets // Clin. Chim. Act. – 2006. – Vol. 363. – P. 120-126.
50. Watkins D.V., Jahangeer S., Floor M.K., Alabaster 0. Magnesium and calcium absorption in Fisher - 334 rats influenced by changes in dietary fibre (wheat bran), fat and calcium // J. Magn. Res. – 1992. – Vol. 5, №1. – P. 15-21.
51. Weissleder R., Elizondo G., Wittenberg J. et al. Ultrasmall superparamagnetic iron oxide: characterization of a new class of contrast agents for MR imaging. // Radiology. – 1990. – Vol. 175, №2. – P. 489-493.
52. Whitesides G. M. The “Right” size in nanobiotechnology // Nat. Biotechnol. – 2003. – Vol. 21. – P.1161-1165.
53. Xiangdong Y., Chengzhang W., Aijun D. et al. Metallic and carbon nanotube-catalyzed coupling of hydrogenation in magnesium // J. Am. Chem. Soc. – 2007. – Vol. 129. – P. 15650-15654.
54. Zhang L., Gu F. X., Chan, J. M. et al. Nanoparticles in medicine: therapeutic applications and developments // Clin. Pharmacol. Ther. – 2008. – Vol. 83. – P. 761-769.
55. Zhang N., Chittasupho C., Duangrat C et al. PLGA nanoparticle peptide conjugate effectively targets intercellular cell- adhesion molecule-1 // Bioconjugate Chem. – 2008. – Vol. 19. – P. 145-152.
56. Zimmer C., Weissleder R., Poss K. et al. MR imaging of phagocytosis in experimental gliomas // Radiology. –1995. – Vol. 197, №2. – P. 533-538.
57. Zinbarg R. G., Barlov D.N., Leibovitz M. et al. The DSM-3 field criteria for mixed anxiety-depression // Am. J. Psychiatry. – 1994. – Vol. 151. – P. 1153-1162.
Кремній
Фізичні, фізико-хімічні, фармакологічні,
токсикологічні та медичні властивості кремнію
вивчені недостаньо. Кремній та його сполуки
зберігають в собі багато тайн”
О.О. Чуйко (1930–2007),
український вчений,
академік НАН України
Надмалий розмір наноматеріалів забезпечує значні можливості, особливо у медицині та фармації. Основна перевага використання наноматеріалів – це можливість змінювати та контролювати їх властивості, залежно від специфіки застосування. Надмалі частинки мають відмінні від вихідних матеріалів хімічні та фізичні характеристики, такі як біосумісність, велику площу активної поверхні, унікальні оптичні властивості. Медичні науки і біотехнології значно виграли від розвитку нанотехнологій. Діагностика та лікування хвороб залежать від глибокого розуміння біохімічних процесів, а нові дослідження нанооб´єктів відіграватимуть надзвичайно важливу роль в майбутньому розвитку галузі [Fadeel B.; Moroghimi SM.10, 19].
Одним з об'єктів, що сьогодні привертає все більше уваги вчених, є кремній. Кремнієві наночастинки. активно досліджуються як ідеальний носій для білкових молекул, оскільки вони хімічно і термічно стабільні, мають велику активну поверхню, добре суспендуються у водних розчинах та відносно інертні у навколишньому середовищі. Крім того, такі наночастинки мають привабливі фізичні та хімічні характеристики: кремній оптично прозорий, не сприяє розвитку мікроорганізмів, може виступати як ізолятор, захищаючи вміст капсули від впливу навколишніх впливів. Існує безліч можливих варіантів застосування створених наночастинок в біотехнологіях та медицині, особливо для біосенсорики, маркування проб, біовізуалізації та в дослідженні різноманітних молекулярних маркерів у клітинній та молекулярній біології. Такі наночастинки поєднують неорганічні та біологічні властивості: спектроскопічні характеристики нанокристалу та біомолекулярну функцію кремнію. Також на поверхні частинок міститься велика кількість силанольних груп, які можуть вступати у хімічні реакції та утворювати звязки з біомолекулами. До кремнієвих наночастинок можуть приєднуватися комплекси біотин-авідин, антиген-антитіло, пептиди, білки, ДНК [Чуйко; Fortina P.11; Dwivedi N.7Wang XD. Shen Z.X;;].
Аналіз вітчизняних та зарубіжних літературних джерел вказує на те, що проблема дослідження і застосування кремнієвих наночастинок у медицині, а особливо у фармакології та фармації, вивчена ще недостатньо (рис. 1).
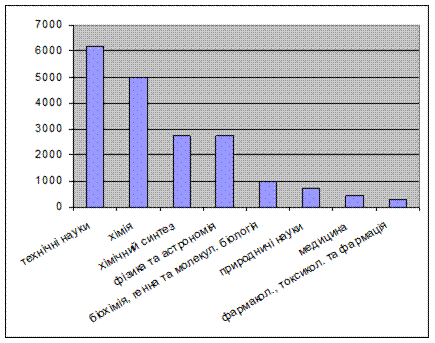
Рис. 1. Кількість статей, присвячених кремнієвим наночастинкам у відповідній науковій галузі [Rnopp D.12].
Для синтезу кремнієвих наночастинок використовують такі методи: зворотнє мікроемульгування та технології Штобера. Колоїдні кремнієві наночастинки з розмірами меньше 100 нм найчастіше отримують за допомогою технології Штобера за допомогою гідролізу алкоксиду кремнію в суміші етанолу та розчину гідроксиду амонію. В процесі синтезу утворюється кремнієва кислота. Поки її концентрація більша за розчинність в даному розчині, відбувається утворення кремнієвих частинок з субмікронними розмірами. Цей метод використовується для отримання чистих наночастинок кремнію. Приєднання органічних компонентів можливе за допомогою модифікації аміновмісним силановим реагентом (наприклад 3-амінопропілетоксисиланом) після гідролізу. Розміри частинок можуть коливатися від 10 нм до 1 мкм в діаметрі і залежать від концентрації вихідних реагентів та температури реакційної суміші. Наступна фільтрація та сепарація допомагають відділити фракції частинок з потрібними розмірами. Такий спосіб виключає можливість утворення комплексів з білками, оскільки етанол та висока кислотність призводять до денатурації білкових молекул. Тому, найчастіше використовують так називаємий „золь-гель” процес, який дозволяє отримувати кремнієві біокомпозити при низькій температі та м'яких хімічних умовах. В іншому випадку застосовують білок стабілізуючі добавки, такі як полімери, цукри, амінокислоти. За допомогою цього методу отримують різноманітні кремнієві біокомпозити з ферментами, антитілами, рецепторами, нуклеїновими кислотами та цілими клітинами. Але процес вивчений ще недостатньо, тому дослідження отриманих сполук на молекулярному рівні та вдосконалення технології їх виробництва триває [Masee S.; Roshi A.; Storm AJ 16, 24, 28].
Метод зворотного мікроемульгування полягає у використанні вода-в-олії мікроемульсії. Нанорозмірні частинки води в олії відіграють роль нанореакторів для розділення частинок. Як і в методі Штобера, кремнієві наночастинки утворюються з силанольних сполук. Діаметр отриманих частинок залежить від розміру частинок води, в яких проходять реакції гідролізу. Але в даному разі процес триває довше – 1-2 дні. Цей метод дозволяє отримувати монодисперсні частинки правильної сферичної форми з розмірами 0,5 – 1000 мкм. Метод зворотнього мікроемульгування може бути використаний і для синтезу наночастинки з металами чи напівпровідникові квантові точки [Liu S.; Han Y. 14, 23].
В Інституті хімії поверхні НАН України досліджують нанодисперний кремнезем, отриманий за допомогою високотемпературного гідролізу тетрахлориду кремнію. Аморфний нанодисперсний кремнезем утворюється при спалюванні тетрахлориду кремнію у воднево–кисневому полум’ї за температури близько 10000 С. Такий кремнезем відомий під назвами аеросил, кабосил, хайсил та характеризується високим ступенем чистоти – вміст SiO2 не менш 99,9%. Адсорбційні і хімічні властивості нанодисперсного кремнезему визначаються головним чином наявністю поверхневих структурних гідроксильних груп та сорбованих молекул води. Первинні частки кремнезему (9 – 10 нм) завдяки численним водневим зв'язкам утворюють так звані вторинні частки або агрегати, розмір яких становить 200–500 нм. Унікальні сорбційні властивості нанодисперсного кремнезему — однорідність, термічна, біологічна, хімічна та радіаційна стійкість — забезпечують можливість застосування у медичній практиці. Адсорбція білків (альбуміни, глобуліни, імуноглобуліни); ферментів (пепсин, амілаза, трипсин, каталаза); амінокислот й інших сполук відбувається в широкому інтервалі pH (від 2 до 8). Максимальна сорбція відбувається при pH=6,4 [Чуйко; Чуйко5,6].
Кремнієві частинки унікальні не лише завдяки власним фізико-хімічним властивостям. Основне застосування знаходять комплексні сполуки, в яких кремній відіграє роль носія. В біологічних дослідженнях широко використовують флуорисценцію. Недоліками існуючих флуорисцентних хромофорів (таких як ізотіоцианат, родамін та цианін) є низька яскравість та нестабільність випромінювання. Використання наночастинок кремнію як капсул для високо активних флюоресціюючих речовин забезпечує в 30000 разів вищу інтенсивтість випромінювання, ніж при використанні одиничних органічних хромофорів [Qian HS; Shi W.18, 25].
Наночастки на основі кремнію дозволяють здійснювати біологічний аналіз для визначення окремих біологічних об’єктів (наприклад, ДНК, антитіл). На поверхні таких наночасток має підтримуватися стабільний запас біолігандів, закріплених за допомогою біохімічних реакцій, що забезпечують біологічну відповідь при взаємодії з відповідною молекулою. Недоліком може бути агрегація та неспецифічне сполучення наночасток із біологічними об'єктами шляхом електростатичних взаємодій [Liu S.15].
Створення комплексних наночастинок все ще залишається складним процесом. Так як жорсткі умови, в яких опиняються ці наночастки, часто призводять до інактивації чутливих біологічних компонентів, було винайдено та розроблено різні способи їх поверхневої модифікації – наприклад, фізичну адсорбцію, афінну взаємодію, ковалентну коньюгацію та використання золь-гелевих матриць. Далі кремнієвї гранули додавали до різних біомолекул, наприклад, білків, нуклеїнових кислот та фосфоліпідів, а також цілих клітин (Рис. 2) [Cauda V.20].
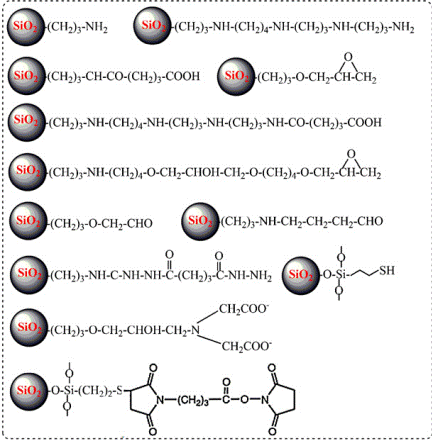
Рис. 2. Варіанти модифікації поверхні наночастинок кремнію різними функціональними групами [McNeil17].
Окрім фізичної адсорбції та ковалентної коньюгації, для певних спеціалізованих біотехнологічих, біоаналітичних та біомедичних завдань (наприклад, у біологічному аналізі, колонках для афінної хроматографії, біокаталізу та терапевтичних процедур) ефективною може бути фізична інкапсуляція біомолекул, тобто їхнє вміщення у пористу матрицю. Використання кремнієвих матриць замість органічних полімерів може мати ряд суттєвих переваг. Наприклад, площа поверхні та середній розмір пор змінними, кремній хімічно інертний, незначно набухає у водному розчині, не має схильності до контамінації мікроорганізмами, оптично прозорий та може підвищити стабільність інкапсульованих біомолекул шляхом захисту від перепадів температури або рН. Інкапсульовані біомолекули менше схильні до вимивання. У якості біокомпозитів використовували ензими, антитіла, мембранні білки та ДНК [Seleem MN.; Song J. Kong H.26, 27].
Також широке застосування знаходять комплекси на основі наночастинок кремнію та металів, наприклад, срібла [Чекман;Carlson 33], заліза [SimonV.; Sunil D.; Taboada E. 21, 29, 30]) .
Існує безліч варіантів застосування кремнієвих наночасток у біотехнологіях та медицині. У той час як у нанобіотехнологіях розглядається розробка нанорозмірних «молекулярних перемикачів», біосенсорів та мікрочипів, у наномедицині основна увага приділяється лікуванню хвороб, діагностиці та удосконаленню фармацевтичних, терапевтичних та діагностичних засобів (Рис. 3) [Mortera R.; Chen AM., Zhang M.8, 9].
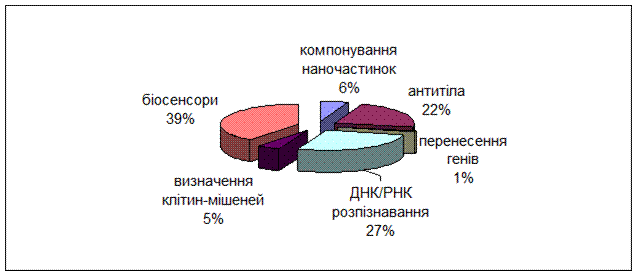
Рис. 3. Кількість статей за період з 1999 по 2008 р., присвячених застосуванню наночастинок кремнію у біотехнологіях та медицині.
Визначення клітин-мішеней.Можливість розпізнати, промаркувати та відобразити конкретні клітини-мішені є надзвичайно важливою у біотехнології, біомедицині та діагностиці. Наприклад, оперативна діагностика захворювань за допомогою простих процедур молекулярного визначення є надзвичайно складним завданням у клінічній патології, оскільки маркування живих клітин або тканин потрібно здійснювати дуже обережно, щоб зберегти їх життєздатність. Створені з використанням засобів біоінженерії комплексні кремнієві наночастки мають ряд унікальних особливостей, порівняно із традиційними способами визначення пухлин in vivo за допомогою радіоактивних сполук та маркованих антитіл. Але існує багато проблем при розробці та створенні комплексних, функціонально спрямованих, дво- та багатокомпонентних наночастинок із прикріпленими молекулярними лігандами, що можуть забезпечувати одержання зображень та проведення терапевтичного лікування. Тому у ході виконання більшості тестів застосовуються умови ex vivo (з використанням протокової цитометрії та конфокальної лазерної скануючої мікроскопії у якості методів розпізнавання), оскільки виникає багато ускладнень при інтеграції наночасток за умов in vivo, (алергічні реакції з боку імунної системи, токсичність та неспецифічна адсорбція) [Kukowska-Latallo13].
Розпізнавання та синтез ДНК/РНК.Здатність до розпізнавання, збору та очищення окремих частин ДНК/РНК у комплексній матриці є надзвичайно важливим у діагностиці захворювань, дослідженнях експресії генів та у визначенні генних профілів. Конмплекси наноматеріальних біополімерів є дуже перспективними у біологічній діагностиці, де наночастки можуть забезпечувати унікальні характеристики розпізнавання, та у нанотехнологіях, де інформаційний зміст біомолекули можна використовувати для просторового зображення наночасток. Кремнієві наночастки, поєднані із магнітними матеріалами або пігментними молекулами, широко застосовуються у зборі, очищенні та розпізнанні ДНК/РНК. Біокон’югація кремнієвих наночасток з молекулами ДНК/РНК може надавати унікальних біофункцій, ці наночастки мають тенденцію до дуже високої люмінесценції та світлостабільності, мають широкий діапазон розмірів – від 5 до 400 нм [Chen AM; 9].
Перенесення генів.Безпечні та ефектив ні системи перенесення генів необхідні та вкрай важливі у генній терапії, оскільки вони використовуються для подолання різних генетичних хвороб, вірусних інфекцій та серцево-судинних порушень. В останні десятиріччя було розроблено багато методів перенесення генів для різних типів клітин та тканин від бактерій до ссавців. Взагалі ці методи можна розподілити на два категорії: вірусні та невірусні (наприклад, органічні катіонні сполуки, рекомбінанті білки та неорганічні наночастки). Для використання in vivo або ex vivo/in vitro було представлено різні вірусні та невірусні вектори для перенесення генів. Вірусні вектори є предметом широких досліджень завдяки їхній високій трансфекційній ефективності, однак сфера їхнього застосування обмежена, оскільки вони зазвичай вимагають складних процедур трансфекції in vitro та, за результатами досліджень, продемонстрували низький рівень безпеки для застосування in vivo. Таким чином, невірусні системи перенесення мали вирішити ці проблеми з безпекою та подолати складнощі, пов'язані із реакцією імунної системи, токсичністю, хромосомною інтеграцією та терміном зберігання (який є закоротким для вірусних векторних систем).
Серед цих невірусних переносників генів нанорозмірні частки кремнію привертають особливу увагу завдяки властивій їм низькій цитотоксичності, високій трансфекційній ефективності, універсальності (у розрізі властивостей та можливих типів модифікацій), необмеженому розміру плазміди, довшому терміну зберігання та можливості повторного використання [Ратнер Thrall JH.31, 4].
Біосенсори.Розробники біосенсорів використовують провідні біотехнології, щоб створити досконалі засоби виявлення та кількісного розрахунку аналітів у клінічних закладах (наприклад, стандартний аналіз крові), на дому (наприклад, моніторинг рівня глюкози), в польових умовах (наприклад, екологічний моніторинг, захист солдат, безпека країни), на виробництві (здоров'я працівників, безпека напоїв та харчових продуктів). В таких пристроях висока продуктивність (зокрема – висока чутливість та селективність) має поєднуватися із компактністю, високою швидкістю роботи та невисокою вартістю. Створення таких пристроїв вимагає новаторського підходу та поєднання біологічної, хімічної наук та матеріалознавства. Наночастки є надзвичайно перспективними у якості універсальних посилюючих маркерів для біологічних проб, наприклад, як активні одиниці у біосенсорних системах. Наразі білкові та нуклеїнові наночастки кремнію, функціоналізовані кислотою, використовуються як маркери посиленої трансдукції біологічного розпізнавання [Whitesides GM.35].
Незалежно від застосування, підготування стабільних, визначених наночасток, функціоналізованих біомолекулами, є вкрай важливим. У останні роки неодноразово повідомлялося про розробку стратегій для іммобілізації та стабілізації біомолекул для застосування у біосенсорах [Wang Y.; Liu B.34].
Шляхом захоплення біомолекул у наносфери на основі кремнію розробники можуть забезпечувати системи високою здатністю до біомолекулярної імобілізації, що мають високу об’ємну активність та покращену механічну стабільність [Tao Z.32].
Імунологічні проби.Імунологічна проба базується на реакції між аналітом (антигеном) та антитілом, результатом якої є формування комплексу. Реакцію можна візуалізувати за допомогою маркерів, наприклад, ензимів та флуорофорів. Для забезпечення точного аналізу потрібні високо афінні антитіла та відповідні маркери. Тому тривають постійні спроби розробити нові маркери, які забезпечують більшу чутливість розпізнання (наприклад, нові люмінофори, маркери комбінаційного розсіювання та квантові точки) та зв’язані із біофункціоналізованими наночастками кремнію [Білоусов УЮ; Пул1, 3].
Заключення.Нанотехнології відносяться до нового, пріоритетного науково-практичного напрямку в сучасній біології і медицини. Вивчення специфічних властивостей нанорозмірних частинок відкриває широкі можливості для створення нових лікарських препаратів, методів діагностики та лікування захворювань. Тому, сфера застосування нанотехнологій як у медицині, так і у фармакології є досить широкою. Найбільш детально вивчені властивості наночастинок силіксу та широко застосовуються у техніці, хімічній індустрії, біохімії, генній і молекулярній біології, фармакології, фармації, у медицині для лікування інфекційних захворювань, у якості біосенсорів, як діагностичний засіб.
Література
1. Белоусов Е.Ю. Нанотехнология на пути продления жизненных процессов в организме / Е.Ю. Белоусов, Н.И. Оболенцев, А.Н. Белоусов // Біль, знеболювання і інтенсивна терапія. — 2005. — №3. — С. 5 — 7.
2. Наносеребро: технологии получения, фармакологические свойства, показания к применению / И.С. Чекман, Б.А. Мовчан, М.И. Загородный [та ін.] // Мистецтво лікування. — 2008. — №6. — С. 26 — 28.
3. Пул Ч. Нанотехнологи / Ч. Пул, Ф. Оуэнс — М. : Техносфера, 2006. — 120с.
4. Ратнер M. Нанотехнология: простое объяснение очередной гениальной идеи / M. Ратнер, Д. Ратнер — М.: Вильямс, 2006. — 240 с.
5. Химия поверхности кремнезёма: в 2 ч / Под ред. академика НАН Украины А.А. Чуйко. — К., 2001. — Ч. 1. — 736 с.
6. Чуйко А.А. Адсорбционное взаимодействие высокодисперсного кремнезема с биомолекулами / А.А. Чуйко, Н.Н. Власова, Н.А. Давиденко // Медицинская химия и клиническое применение диоксида кремния. — К. : Наукова думка, 2003. — С. 116 — 152.
7. Dwivedi N. Ferrite—Silica—Insulin Nanocomposites (FeSINC) for Glucose Reduction / N. Dwivedi, S. Sharma, J. Bellare // Langmuir. — 2009 — №4. — P. 145—150.
8. Cell—induced intracellular controlled release of membrane impermeable cysteine from a mesoporous silica nanoparticle—based drug delivery system / R. Mortera, J. Vivero—Escoto, I.I. Slowing, E. Garrone // Chem. Commun. (Camb). — 2009 Vol.14, №22. — P. 3219—21.
9. Co—delivery of Doxorubicin and Bcl—2 siRNA by Mesoporous Silica Nanoparticles Enhances the Efficacy of Chemotherapy in Multidrug—Resistant Cancer Cells / A.M. Chen, M. Zhang, D. Wei [et al.] // Small. — 2009. — №24. — P. 123—129.
10. Fadeel B. Better safe than sorry: Understanding the toxicological properties of inorganic nanoparticles manufactured for biomedical applications / B. Fadeel, A.E. Garcia—Bennett // Adv. Drug. Deliv. Rev. — 2009 — Vol.10, № 23. — P. 9204—9.
11. Fortina P. Nanobiotechnology: the promice and reality of new approaches to molecular recognition / P. Fortina, L.J. Kricka, S. Surrey // Trends Biotechnol. — 2005. — Vol. 23, № 5. — P. 168 — 173.
12. Knopp D. Review: Bioanalytical applications of biomolecule—functionalized nanometer—sized doped silica particles / D. Knopp, D. Tang, R. Niessner // Analytica Chimica Acta — 2009. — №64. — P. 14 — 30
13. Kukowska—Latallo J.F. Nanoparticle targeting of anticancer drug improves therapeutic response in animal model of human epithelial cancer / J.F. Kukowska—Latallo // Cancer Res. — 2005. — № 65. — P.5317—5324
14. Liu S. Silica—Coated Metal Nanoparticles / S. Liu, M.Y. Han // Chem. Asian. J. — 2009. — 18. — P. 1245—1249.
15. Liu Y. Nanomedicine for drug delivery and imaging: а promising aventure for cancer therapy and diagnosis using targeted functional nanoparticles / Y. Liu, H. Miyoshi, M. Nakamura // Int. J. Cancer. — 2007. — Vol. 120, № 21. — P. 2527 — 2537.
16. Masse S. Influence of cyclic polyamines on silica formation during the Stöber process / S. Masse, G. Laurent, F. Coradin // Phys. Chem. — 2009. — Vol.11, № 43. — P. 10204—10.
17. McNeil S.E. Nanotechnology for the biologist / S.E. McNeil // J. Leukoc Biol. — 2005. — № 16. — P. 585 — 594.
18. Mesoporous—Silica—Coated Up-Conversion Fluorescent Nanoparticles for Photodynamic Therapy / H.S. Qian, H.C. Guo, P.C. Ho [et al.] // Small. — Vol.5, №20. — P. 2285—2290.
19. Moroghimi S.M. Nanomedicine: current status and future prospects / S.M. Moroghimi, A.C. Hunter, J.C. Murray // FASEB J. — 2005. — Vol. 19,№ 15. — P. 311 — 330.
20. Multiple core—shell functionalized colloidal mesoporous silica nanoparticles / V. Cauda, A. Schlossbauer, J. Kecht [et al.] // J. Am. Chem. Soc. — 2009. — Vol.131, №32. — P. 11361—70.
21. Preparation and Characterization of Fe(3)O(4)/CdTe Magnetic/Fluorescent Nanocomposites and Their Applications in Immuno—Labeling and Fluorescent Imaging of Cancer Cells / V. Simon, C. Devaux, A. Darmon [et al.] // Photochem. Photobiol. — 2009 — 21. — P. 234—240.
22. Preparation of spherical silica particles by Stöber process with high concentration of tetra—ethyl—orthosilicate / X.D. Wang, Z.X. Shen, T. Sang [et al.] // J. Colloid Interface Sci. — 2008 — Vol.341, №1 — P. 23—9.
23. Reverse Microemulsion—Mediated Synthesis of Silica—Coated Gold and Silver Nanoparticles / Y. Han, J. Jiang, S.S. Lee [at al.]. // Langmuir. — 2008. — №24. — Р. 5842 — 5848.
24. Roshi A. Structure and dynamics of a nanocolloidal silica gel dispersion / A. Roshi, S. Barjami, G.S. Iannacchione // Phys. Rev. E. Stat. Nonlin. Soft. Matter. Phys. — 2006. — №12. — P. 74.
25. Shi W. The fabrication of photosensitive self—assembly Au nanoparticles embedded in silica nanofibers by electrospinning / W. Shi, W. Lu, L. Jiang // J. Colloid. Interface. Sci. — 2009 — Vol.340, №2 — P. 291—7.
26. Silica—antibiotic hybrid nanoparticles for targeting intracellular pathogens /
M.N. Seleem, P. Munusamy, A. Ranjan [et al.] // Antimicrob. Agents Chemother. — 2009. — Vol.53, №10. — P.4270—4.
27. Song J. Enhanced antibacterial performance of cationic polymer modified silica nanoparticles / J. Song, H. Kong, J. Jang // Chem Commun (Camb). — 2009. — №6. — P. 5418—20.
28. Storm A.J. Fabrication of solid — state nanopores with single — nanometre precision / A.J. Storm, J.H. Chen, X.S. Ling // Nat. Mater. — 2003. — Vol. 2, №8. — P. 537 — 540.
29. Sunil D. Influence of amorphous silica matrices on the formation, structure, and chemistry of iron and iron oxide nanoparticles / D. Sunil, J. Dong, H.D. Gafney // J. Am. Chem. Soc. — 2009. — Vol.131, №41 — P. 14768—77.
30. Taboada E. Nanospheres of Silica with an epsilon—Fe(2)O(3) Single Crystal Nucleus / E. Taboada, M. Gich, A. Roig // ACS Nano. — 2009 — Vol.10, №12 — P. 4123—8.
31. Thrall J.H. Nanotechnology and medicine / J.H. Thrall // Radiology. — 2004. — Vol. 230. — P. 315 — 318.
32. Tao Z. Mesoporosity and Functional Group Dependent Endocytosis and Cytotoxicity of Silica Nanomaterials / Z. Tao, B.B. Toms, J. Goodisman // Chem Res Toxicol. — 2009.— Vol.21, №9 — P. 13—20.
33. Unique Cellular Interaction of Silver Nanoparticles: Size—Dependent Generation of Reactive Oxygen Species / C. Carlson, S.M. Hussain, A.M. Schrand et al. // J. Phys. Chem. B. — 2008. — P. 50—53.
34. Wang Y. Conjugated polyelectrolyte—sensitized fluorescent detection of thrombin in blood serum using aptamer—immobilized silica nanoparticles as the platform / Y. Wang, B. Liu // Langmuir. — 2009 — Vol.25, №21. — P. 12787—93.
35. Whitesides G.M. Nanociens, nanotechnology and chemistry / G.M. Whitesides // Small. — 2005. — Vol. 125. — P. 172 — 179.
Дата добавления: 2016-08-08; просмотров: 1480;
