Примеры составления задач и их решения
Задача 858
Какие из перечисленных ниже солей подвергаются гидролизу: NH4I, Na2S, Al(CH3COO)3, CaCl2?
Решение:
Иодид аммония - соль, образованная сильной кислотой и слабым основанием. Гидролиз соли: гидролизу подвергается катион соли. Реакция раствора кислая: рН<7.
NH4I + HOH « NH4OH + HI.
Или в ионном виде:
NH4+ + HOH « NH4OH + H+.
Сульфид натрия – соль, образованная сильным основанием и слабой кислотой.
При растворении солей многоосновных кислот гидролиз протекает ступенчато:
Na2S + H2O « NaHS + NaOH.
Или в ионной форме:
S2– + H2O « HS– + OH–.
Гидролизу подвергается анион соли. Процесс отражает гидролиз по первой стадии.
Чтобы гидролиз соли многоосновной кислоты прошел полностью, как правило, увеличивают температуру процесса:
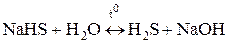 ,
,
или в ионной форме: 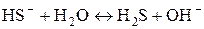 .
.
Раствор такой соли проявляет щелочную реакцию рН>7.
Ацетат алюминия – соль, образованная слабым основанием и слабой кислотой. Гидролизу подвергается как катион, так и анион соли:
Al(CH3COO)3 + H2O « AlOH(CH3COO)2 + CH3COOH.
Параллельно идут два процесса:
Al3+ + H2O « AlOH2+ + H+,
CH3COO– + H2O « CH3COOH + OH–.
В этом случае реакция раствора зависит от относительной силы кислоты и основания, образующих соль. Для гидролиза А1(СН3С00)3 реакция полученного раствора будет слабокислотной, поскольку константа диссоциации А1(OН)3 (К=1,38×10-9) меньше константы диссоциации уксусной кислоты (К=I,75×10-5).
Хлорид кальция - соль, образованная сильным основанием и сильной кислотой. Взаимодействие с водой можно представить таким образом:
CaCl2 + 2H2O «Ca(OH)2 + 2HCl,
H2O « H+ + OH–.
Однако единственным малодиссоциирующим соединением в реакции остается сама вода, следовательно, равновесие реакции полностью смещено влево - гидролиз не идет. Раствор соли проявляет нейтральную среду.
Реакция гидролиза представляет собой эндотермический процесс. Поскольку гидролиз является обычным равновесным процессом, то он зависит от всех тех факторов, которые влияют на равновесие реакций, и к нему применимо правило Ле-Шателье.
Задача 864
Вычислить константу гидролиза NН4Сl.
Решение:
Гидролиз соли, образованной слабым основанием и сильной кислотой, характеризуется константой гидролиза:
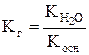 ,
,
где 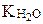 - ионное произведение воды; Косн – константа диссоциации основания.
- ионное произведение воды; Косн – константа диссоциации основания.
Из табл. 7 приложения находим 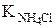 = 1,8 × 10-5 .
= 1,8 × 10-5 .
Отсюда
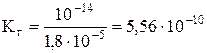 .
.
Задача 880
Вычислить степень гидролиза ZnCl2 по 1 ступени в 0,5 М растворе.
Решение:
Ионное уравнение гидролиза
Zn2+ + H2O « ZnOH+ + H+,
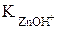 = 1,5×10-9.
= 1,5×10-9.
Степень гидролиза вычисляем по формуле:
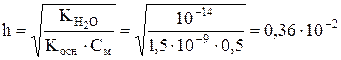 (0,36 %).
(0,36 %).
Степень гидролиза соли тем больше, чем меньше ее концентрация; иначе говоря, при разбавлении раствора гидролизующейся соли степень ее гидролиза возрастает.
При выполнении заданий рекомендуется использовать методические указания [8].
При решении задач по гидролизу использовать данные констант диссоциации некоторых электролитов, приведенные в табл. 7 приложения.
В задачах 825–858 указать, какие из перечисленных ниже солей подвергаются гидролизу. Для каждой из гидролизующихся солей написать в молекулярной и ионной форме уравнения гидролиза, указать реакцию водного раствора соли
| задачи | |
| CrCI3, Na2S, AI2S3, KNO3 Zn(NO3)2, NaNO2, Ba(NO3)2, (NH4)2S MnSO4, CH3COONH4, KCI, NaHSO3 Na2SiO3, CuSO4, NaBr, Pb(CH3COO)2 NaH2PO4, AI2(SO4)3, NH4CN, BaCI2 Ca(HS2), Fe(CN)2, Ni(NO3)2, NaCI HCOONH4, FeCI3, KHCO3, Li2SO4 (CuOH)2SO4, (NH4)2CO3, K2SO4, Ba(NO3)2 Cr2(SO4)3, K2S, Na2SO4, Cr2S3 Na3AsO4, CoSO4, NaCIO4, Al2S3 CsNO3, K2HAsO4, NH4CIO4, Cu(CH3COO)2 Na2TeO3, ZnSO4, KJ, Fe(HCOO)3 K2HAsO4, NH4Br, RbNO3, Al(CH3COO)3 CaS, SrCl2, MgSO4, (NH4)2SO3 |
| K2Se, BaJ2, Pb(CH3COO)2, SnSO4 NH4CN, Mg(ClO4)2, Ca(HS)2, RbCl Ca(NO2)2, Li2CrO4, Cr2S3, Zn(NO3)2 (ZnOH)2SO4, NaAsO2, Fe(CN)2, K2SO4 Zn(CN)2, Li2SO3, MnSO4, (NH4)2CO3 Bi(NO3)2, Li2SiO3, KJ, (NH4)2CO3 SbCl3, K2CrO4, Zn(CN)2, CdSO4 CH3COOK, Fe2(SO4)3, BaCl2, Al2S3 Al2S3, CsNO3, NH4ClO4, K2Te K2Te, SnSO4, Cu(CN)2, NaNO3 CuOHCl, NaH2PO4, NaBr, Cu(CH3COO)2 SrS, FeCl3, NH4CN, K2SO4 K2CO3, NaNO2, NH4HCOO, LiCl NaClO3, (NH4)2SO4, CH3COOK, KNO3 CuCl2, Ca(CH3COO)2, Pb(NO3)2, NaBr FeCl3, (NH4)2CO3, Na3PO4, K2CrO4 NaHS, Al2S3, MnCl2, Ba(NO3)2 NaHSO3, MnJ2, (NH4)2S, KSCN NaClO4, Mg(CH3COO)2, Ni3(PO4)2, RbCl NH4J, Na2S, Al(CH3COO)3, CaCl2 |
В задачах 859–868 вычислить константу гидролиза
| ацетата натрия формиата натрия ацетата калия карбоната калия ортофосфата калия | хлорида аммония гипохлорида натрия цианида натрия гидрокарбоната калия сульфита калия |
В задачах 869–880 вычислить степень гидролиза
| № задачи | |
| Цианида калия в 0,1 Н растворе Ацетата калия в 0,1 М растворе 0,1 М раствора ортофосфата калия Карбоната натрия по I ступени в 0,2 М растворе Ортофосфата натрия по I ступени в 0,1 М растворе В 0,01 М растворе гидрокарбоната натрия Цианида аммония в 0,01Н растворе Хлорида аммония в 0,01 М растворе Гипохлорида калия в 0,001 М растворе В 0,06 М растворе нитрата свинца по I ступени Формиата лития в 0,001 н растворе Хлорида цинка по I ступени в 0,5 М растворе |
СТРОЕНИЕ АТОМА
Вся совокупность сложных движений электрона в атоме описывается четырьмя квантовыми числами: главным n , побочным ℓ , магнитным mℓ и спиновым mS.
Главное квантовое число n определяет общую энергию электрона на данной орбитали и его удаленность от ядра. Оно может принимать любые целые значения, начиная с единицы: 1,2,3,4... ¥. Под главным квантовым числом, равным ¥, подразумевают, что атому сообщена энергия, достаточная для полного отделения электрона от ядра (ионизация атома). N = 2n2 – максимальное число электронов, которое находится на каждом энергетическом уровне.
Энергетические уровни представляют собой совокупность некоторых энергетических подуровней. Существование различий в энергетическом состоянии электронов отражается побочным (орбитальным) квантовым числом ℓ. Это квантовое число может принимать целочисленное значение от 0 до n-1 (ℓ = 0, 1, 2 ... n - 1). Численные значения ℓпринято обозначать буквенными символами:
| Значение ℓ | |||||
| Буквенное обозначение | s | p | d | f | g |
В этом случае говорят о s, p, d, f, g, – состояниях электронов, или s, p, d, f, g –орбиталях. Орбиталь – совокупность положений электрона в атоме, т.е. область пространства, где энергетически выгоднее всего находиться электрону.
ℓ – определяет форму электронного облака, а также орбитальный момент – момент количества движения электрона при его вращении вокруг ядра (отсюда и второе название этого квантового числа – орбитальное). Если ℓ = 0 (s -орбиталь), то электронное облако имеет сферическую форму и не обладает направленностью в пространстве. При ℓ = 1(р -орбиталь) электронное облако имеет форму гантели, т.е. форму тела вращения, полученного из "восьмерки". При ℓ = 2 (d- орбиталь) электронное облако имеет четырехлепестковую фигуру. Формы f и g электронных облаков намного сложнее. Максимальное число электронов на подуровне рассчитывается по формуле 2(2ℓ + 1).
Ориентация электронного облака в пространстве не может быть произвольной. Она определяется значением третьего, так называемого магнитного квантового числа mℓ.
mℓ может принимать значения любых целых чисел, как положительных так и отрицательных от -1до +1, включая 0, т.е. всего (2ℓ + 1) значений. Например, при l = 0 mℓ = 0; при ℓ = 1 mℓ равно -1, 0, +1; при ℓ, равном 3, mℓ имеет семь значений (2ℓ + 1 = 2∙3 + 1 = 7): -3, -2, -1, 0, +1,+2,+3 – семь различных ориентаций f электронных облаков в пространстве.
mS – спиновое квантовое число определяет собственное состояние электрона, результат вращения электрона вокруг своей оси. Спиновое квантовое число может иметь два значения: +1/2 или -1/2. Итак, состояние электронов можно описать набором четырех квантовых чисел, но для объяснения строения электронных оболочек атомов нужно знать еще три основных положения: принцип Паули, правило Хунда, принцип наименьшей энергии.
Принцип Паули. В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми.
Правило Хунда. При данном значении ℓ (то есть в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным.
Принцип наименьшей энергии – правило Клечковского: в атоме каждый электрон располагается так, чтобы его энергия была минимальна (что отвечает наибольшей его связи с ядром). Энергия электрона в основном определяется главным квантовым числом n и побочным числом ℓ, поэтому сначала заполняются те подуровни, для которых сумма значений n + ℓ является меньшей (энергия электрона на подуровне 4s меньше , чем на подуровне 3d, так как n + ℓ = 4 + 0 = 4 для 4s и n + ℓ = 3 + 2 = 5 для 3d. Когда для двух подуровней суммы n + ℓ равны, сначала идет заполнение с меньшим значением n (на подуровнях 3d, 4p, 5s n + ℓ = 5 – в этом случае происходит заполнение подуровней сначала с меньшим значением n , т.е. 3d ® 4p ® 5s).
Дата добавления: 2016-08-07; просмотров: 1268;
