Ионное произведение воды. Водородный показатель. Вода является слабым электролитом и в незначительной степени диссоциирует:
Вода является слабым электролитом и в незначительной степени диссоциирует:
Н2О = Н+ + ОН–.
Константа равновесия этого процесса при 22 °С:
К=[Н+]×[ОН–]/[Н2О]=1,8×10-16.
Молярная концентрация воды [Н2О] вследствие незначительной диссоциации практически равна общей концентрации воды в 1 л:
[Н2О] = 1000/18 = 55,56 моль/л.
Тогда [Н+]×[ОН–]= К×[Н2O] = 1,8×10-16×55,56 = 10-14 – эта постоянная величина называется ионным произведением воды.
Обозначается Кводы= [Н+]×[ОН–].
В нейтральном растворе концентрации ионов Н+ и ОН– равны между собой:
[Н+] = [ОН–] = 10-7 моль/л.
Однако только в разбавленных растворах можно пользоваться истинными концентрациями Н+ и ОН–. В концентрированных растворах нужно пользоваться активными концентрациями.
Водородный показатель рН является количественной характеристикой среды раствора и вычисляется через отрицательный десятичный логарифм от концентрации ионов Н+:
pН = -lg[Н+].
Для нейтральных растворов [Н+] = [ОН–] = 10–7, рН = 7; для кислых – [Н+] > 10–7, рН < 7; для щелочных [Н+] < 10-7, рН > 7.
Гидиоксильный показатель рОН можно определить как
рОН = -lg [ОН–].
Логарифмируя соотношение [Н+]×[ОН-] = 10-7 и меняя знаки на обратные, получим
рН + рОН = 14 при 22 °С.
Примеры составления задач и их решения
Задача 754
Вычислить рН 0,1М раствора циановодородной кислоты по величине ее константы диссоциации.
Решение:
Находим степень диссоциации кислоты
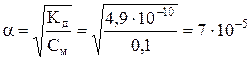 .
.
Отсюда [Н+]= См · a = 0,1·7· 10-5 =7·10-6 моль/л. Водородный показатель раствора HСN
рН = - lg[Н+] = -lg (7·10-6) =5,15.
Задачу можно решить и другим способом:
[Н+]=a· См= 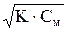 . Тогда [Н+] =
. Тогда [Н+] = 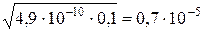 .
.
Задача 766
Вычислить рН 0,175 М раствора азотной кислоты.
Решение:
Азотная кислота – сильный электролит, ее активная концентрация будет отличаться от истинной. Поэтому в таких случаях надо вносить поправку на активность электролита.
Находим предварительно ионную силу раствора HNO3:
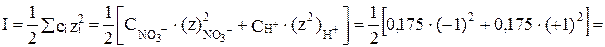
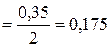 .
.
В табл. 6 прил. находим коэффициент активности иона Н+ для вычисленной ионной силы раствора fH+ = 0,838. Определяем активность ионов водорода:
аH+ =f·См=0,838·0,175=0,147.
Вычисляем водородный показатель:
pH = -lg аH+ = - lg 0,147 = 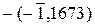 = –(–1 + 0,1673) = 0,8327;
= –(–1 + 0,1673) = 0,8327;
pH = 0,83.
При выполнении заданий рекомендуется использовать методические указания [8] и табл. 6,7 приложения.
В задачах 754–765 вычислить рН 0,1М растворов слабых электролитов по величине их констант диссоциации (табл. 7 приложения)
| № задачи | Электролит | № задачи | электролит | № задачи | Электролит |
| НСN H2S Н2СO3 NН4ОН | СН3СООН HNO2 H2О2 Н2SO3 | НСООН Н2С2O4 Al(OH)3 Cu(OH)2 |
В задачах 766–775 вычислить рН растворов сильных электролитов с учетом их коэффициентов активности
| № задачи | электролит | Концентрация, моль/л |
| HNO3 HClO4 HCI НI Н2SO4 KOH NaOH LiOH Ва(ОН)2 RbOH | 0,175 0,150 0,205 0,100 0,100 0,130 0,100 0.100 0.200 |
Дата добавления: 2016-08-07; просмотров: 1038;
