Примеры составления задач и их решение
Задача 915
Определить степень окисления и координационное число комплексобразователя в комплексном соединении [CrBr(NH3)4(H2O)]Cl2. Написать уравнение первичной диссоциации комплексного соединения. Определить гибридные орбитали и пространственную структуру комплексного иона. Назвать комплекс.
Решение:
Комплексообразователем является хром. По внешней сфере определяем заряд комплексного иона [CrBr(NH3)4(H2O)]2+. Зная заряд комплексного иона, определяем степень окисления комплексообразователя [CrBr(NH3)4(H2O)]2+:
X + (-1) = +2,
X = 3.
Следовательно, степень окисления хрома равна трем (III).
Лигандами являются ион Вг– и нейтральные молекулы NН3, Н2O . Все лиганды монодентантные. Координационное число равно количеству лигандов, т.е. шести.
В растворах комплексные соединения подвергаются диссоциации с отщеплением внешней сферы по типу диссоциаций сильных электролитов (первичная диссоциация):
[CrBr(NH3)4(H2O)]Cl2 = [СrВг(NН3)4(Н2O)]2+ + 2Сl-.
Изобразим электронно-графическую формулу иона Сr3+:
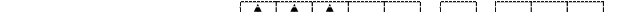
Cr3+ ….3d34s04p0 .
В образовании связей с лигандами участвуют свободные орбитали 3d, 4s и 4р: происходит d2sp3 – гибридизация:



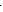

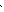


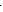
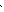
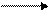 Cr3+ + Br- +4NH3 + H2O
Cr3+ + Br- +4NH3 + H2O

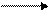 [CrBr(NH3)4(H2O)]2+
[CrBr(NH3)4(H2O)]2+
Пространственная структура иона [CrBr(NH3)4(H2O)]2+ – октаэдр.
Комплексное соединение [CrBr(NH3)4(H2O)]Cl2 называется хлорид акватетраамминбромохрома (III).
При выполнении заданий рекомендуется использовать методические указания [10].
Дата добавления: 2016-08-07; просмотров: 645;
