Произведение растворимости
В насыщенном растворе малорастворимого электролита устанавливается равновесие между осадком электролита и ионами электролита в растворе.
Например: BaSO4 ↔ Ва2+ + SO42– .
в осадке в растворе
В растворах электролитов состояние ионов определяется их активностями, поэтому константа равновесия процесса выразится следующим уравнением:
К= α (Ва2+) · α (SO42-) / α (ВаSO4).
Активность твердого сульфата бария есть величина постоянная, отсюда следует, что произведение активностей ионов Ва2+ и SO42– есть постоянная величина, называемая произведением растворимости,и обозначается
α Ва2+ · α SO42- = ПР ВаSO4 .
Если электролит очень мало растворим, то произведение активностей ионов можно заменить произведением их концентраций
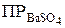 = [Bа2+ ] · [SO42– ] .
= [Bа2+ ] · [SO42– ] .
Если молекула электролита при диссоциации образует два и несколько одинаковых ионов, то концентрации этих ионов должны быть возведены в соответствующие степени, например:
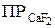 = [Cа2+ ] · [F– ]2.
= [Cа2+ ] · [F– ]2.
Условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над его произведением растворимости. Растворение же осадка малорастворимого электролита происходит при условии, что произведение концентраций его ионов меньше значения произведения растворимости.
Исходя из значений ПР, можно вычислять растворимость малорастворимых электролитов в воде и растворах, содержащих другие электролиты.
Примеры составления задач и их решения
Задача 798
Вычислить произведение растворимости фосфата серебра, если его растворимость равна 0,0065 г/л.
Решение:
Находим растворимость Ag3PO4 . Молярная масса Ag3PO4 равна 418,6 г/моль. Растворимость:
S = 6,5·10-3 / 418,6 = 1,6·10-5 моль/л.
При диссоциации Ag3PO4 образуется три иона Ag+ и один ион РO43– :
АgзРO4 = 3 Ag+ + PO43–,
поэтому [PO43–] равна растворимости Ag3PO4 , а концентрация иона Ag+ в 3 раза больше, т.е.
[РO43–] = 1,6·10-5 моль/л; [Ag+]=3·1,6·10-5 =4,8·10-5 моль/л.
Произведение растворимости Ag3PО4:
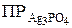 = [Ag+]3 · [ PO43–] = (4,8·10-5)3 · 1,6·10-5=1,77·10-18.
= [Ag+]3 · [ PO43–] = (4,8·10-5)3 · 1,6·10-5=1,77·10-18.
Задача 824
Произведение растворимости иодида свинца при 20 oC равно 8·10–9. Вычислить растворимость соли (в моль/л и в г/л) при указанной температуре.
Решение:
Обозначим искомую растворимость через S (моль/л). Тогда в насыщенном растворе PbI2 содержится S моль/л ионов Pb2+ и 2S моль/л ионов I–. Отсюда:
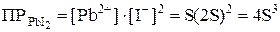 ;
;
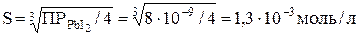 .
.
Поскольку мольная масса PbI2 равна 461 г/моль, то растворимость PbI2, выраженная в г/л, составит 1,3∙10–3∙461 = 0,6 г/л.
В задачах 798–812 вычислить произведение растворимости малорастворимых электролитов
| № задачи | Электролит | Растворимость электролита |
| Ag3РO4 Мg(ОН)2 АgСl ВаСО3 СаСO3 PbSO4 AgIO3 BaSO4 PbBr2 CaF2 PbCI2 AgBr MgCO3 PbBr2 PbI2 | 0,0065 г/л 0,012 г/л 0,0018 г/л 8,9·10-5 моль/л 1,3·10-4 моль/л 0,132 г в 3 л 0,176 г Ag+ в 3 л 2,3·10-3 г/л 2,7·10-2 моль/л 2·10-4 моль/л 11 г/л 1,1·10-4 г/л 2,67·10-3г/л 0,0427 г/л 1 г в 1470 мл воды |
В задачах 813-824 вычислить растворимость электролита по величине произведения растворимости (прил. табл.8)
| № задачи | Электролит | № задачи | Электролит | № задачи | Электролит |
| ВаСгО4 Ag2SO3 AgSCN SrCrO4 | CaC2O4 CaSO4 Ag2CrO4 Ag2CO3 | Сu(ОН)2 СuS BaF2 PbI2 |
Гидролиз солей
Гидролиз солей относится к обменным реакциям, поскольку процесс идет без изменения степени окисления реагирующих веществ. Сущность реакций гидролиза состоит во взаимодействии ионов соли с ионами водыс образованием слабых электролитов. В процессе гидролиза один из ионов воды связывается в слабый электролит, а другой, как правило, накапливается в растворе. Тот ион, который накапливается в растворе, определяет реакцию среды. Если накапливаются ионы Н+, то среда будет кислой, если группы ОН – щелочной. При образовании одинаковых по силе электролитов среда может быть и нейтральной. Последний случай встречается редко.
Уравнения гидролиза пишутся аналогично другим ионным уравнениям: малодиссоциированные (в том числе и вода) и малорастворимые, а также газообразные вещества пишутся в виде молекул, сильные электролиты записываются в виде ионов. Уравнения гидролиза солей многоосновных кислот и многокислотных оснований записываются по ступеням, аналогично ступенчатой диссоциации.
Гидролиз солей, или их обменное взаимодействие с водой, происходит лишь в тех случаях, когда ионы, образующиеся в результате электролитической диссоциации соли–катион, анион или оба вместе, способны образовывать с ионами воды Н+ и ОН– – малодиссоциированные сочетания. Гидролизу подвергаются соли, образованные: слабыми кислотами и сильными основаниями; слабыми основаниями и сильными кислотами; слабыми кислотами и слабыми основаниями.
Если процесс гидролиза необходимо усилить, то следует разбавить раствор и повысить температуру.
Если необходимо уменьшить гидролиз солей, то к раствору добавляют кислоту или щелочь в зависимости от типа гидролизуемой соли.
Дата добавления: 2016-08-07; просмотров: 1649;
